Número Atual: Outubro-Dezembro 2023 - Volume 7 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Comunicação Clínica e Experimental
Indução oral rápida de tolerância a alopurinol: um relato de caso
Rapid induction of oral tolerance to allopurinol: a case report
Caroline Rosa Emergente Coutinho; Larissa Oliveira F. Silva-Lima; Mariana S. Soares Peron; Bruna C. Valdivieso; Erika P. Souza; Eli Mansour
Universidade Estadual de Campinas (UNICAMP), Serviço de Imunologia Clínica e Alergia, Departamento de Clínica Médica, Faculdade de Ciências Médicas - Campinas, SP, Brasil
Endereço para correspondência:
Caroline Rosa Emergente Coutinho
E-mail: c.rosacoutinho@gmail.com
Submetido em: 01/12/2023
Aceito em: 26/12/2023.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
O alopurinol, de uso contínuo oral, é o tratamento de escolha para os distúrbios hereditários do glicogênio. Apesar de não ser comum, a reação de hipersensibilidade ao alopurinol se torna um problema quando esta é a única medicação disponível para o controle da doença de base. Nestes casos, a dessensibilização é uma alternativa viável. No presente relato, descrevemos o caso de um paciente com diagnóstico de doença de depósito de glicogênio tipo I, com exantema pruriginoso generalizado ao alopurinol, tratado com um protocolo de dessensibilização oral acelerado. Este tratamento permitiu o uso contínuo deste medicamento sem novas reações em longo prazo.
Descritores: Hipersensibilidade a drogas, dessensibilização imunológica, doença de depósito de glicogênio.
Introdução
As doenças de armazenamento do glicogênio, ou glicogenoses (Glycogen Storage Diseases - GSD), são distúrbios metabólicos hereditários, decorrentes de defeitos da síntese ou da degradação do glicogênio1. Dos subtipos existentes, a doença de armazenamento tipo I (GSD I) foi a primeira a ter seu mecanismo identificado, e por isso é assim denominada. Possui herança autossômica recessiva, com incidência de 1 em 100.000 indivíduos. Quanto à sua etiologia, pode ser causada por uma deficiência de glicose-6-fosfatase (subtipo GSD-Ia), ou do transportador de glicose-6-fosfato (GSD-Ib). A GSD-I pode apresentar retardo de crescimento, hipoglicemia intermitente, hepatomegalia, insuficiência renal progressiva, hiperlactatemia, hiperuricemia, hiperlipidemia, anemia e neutropenia2. Cerca de 71% dos acometidos apresentarão alterações metabólicas, dentre elas a hiperuricemia, que é secundária à diminuição da depuração renal e ao aumento da produção por meio da degradação de nucleotídeos de adenina3. Uma vez que a associação entre hiperuricemia e doenças renais, cardiovasculares, diabetes e gota é conhecida, reforça-se a importância do tratamento desta condição a fim de minimizar tais complicações4,5. O tratamento atual da hiperuricemia consiste em restrição alimentar, com alguns tipos de dieta em estudo, como dieta DASH, dieta mediterrânea e dieta com baixo teor de purinas; e uso de alopurinol6.
O alopurinol é um medicamento amplamente utilizado no tratamento dos pacientes portadores de hiperuricemia e/ou gota. É considerada uma terapia de primeira linha e de baixo custo. A maior parte da ação do alopurinol é resultado da atividade do seu principal metabólito funcional, o oxipurinol, inibindo a xantina oxidase, enzima responsável por catalisar a oxidação da hipoxantina e da xantina em ácido úrico, resultando então na diminuição da produção de ácido úrico e consequente redução dos níveis deste no sangue e na urina7,8. Apesar de muito utilizado e geralmente bem tolerado, o alopurinol pode levar a reações de hipersensibilidade, sendo este medicamento uma importante causa de reações adversas cutâneas graves em todo o mundo. No entanto, estas reações relacionadas ao alopurinol podem variar desde erupção maculopapular leve até reações cutâneas graves e potencialmente fatais, como a síndrome de Stevens-Johnson (SSJ), a necrólise epidérmica tóxica (NET) e a reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS)7. Nas últimas décadas, alguns estudos vêm tentando identificar uma relação entre predisposição genética e as reações adversas medicamentosas cutâneas induzidas pelo alopurinol. Dentre estes, um estudo com pacientes chineses, demonstrou uma forte relação entre marcadores genômicos HLA e o risco de desenvolver SSJ e NET9. Até o momento, alguns dos fatores identificados como de risco para esta associação são: sexo feminino, idade avançada, portadores de doença renal crônica ou doenças cardiovasculares, uso inicial de doses elevadas do alopurinol e portadores de HLA-B 58:017.
Reação adversa a drogas (RAD) é definida como qualquer efeito não terapêutico decorrente do uso de um fármaco em doses habitualmente terapêuticas. É possível classificar as RADs em previsíveis e imprevisíveis. As reações previsíveis, ou do tipo A, são aquelas causadas diretamente pela medicação administrada. Já as reações imprevisíveis, ou do tipo B, não estão diretamente relacionadas com os efeitos da medicação, mas são por intolerância e de hipersensibilidade, podendo ser alérgica ou resultantes da interação direta do fármaco com receptores de células imunes. O mecanismo de hipersensibilidade das RADs se dá pelo estímulo ao sistema imune por partículas potencialmente imunogênicas. Em alguns casos, um determinado fármaco, um hapteno, se liga a uma proteína carreadora, formando assim um complexo alergênico. A alergia aos betalactâmicos é um exemplo deste mecanismo. Nas reações pseudoalérgicas ocorre a ativação de mecanismos inflamatórios, sem o envolvimento do sistema imune adaptativo, provocando quadro clinicamente semelhante às reações IgE-mediadas. Este processo se dá pela ativação de receptores celulares de inflamação ou pelo bloqueio de enzimas, levando, por consequência, a um aumento de mediadores inflamatórios. São exemplos a ativação direta do MRGPRX2 nos mastócitos e a inibição da cicloxigenase pelos anti-inflamatórios não esteroidais (AINEs). O Conceito p-i é um fenômeno que ocorre pela ligação não covalente entre um fármaco e receptores de células do sistema imune, HLA e TCR, levando à formação de uma resposta mediada por células T, desencadeando o quadro de hipersensibilidade aloimune. Este mecanismo não requer uma segunda sinalização para desencadear uma forte reação mediada por célula T, sendo algumas RADs ao alopurinol um exemplo10,11.
O tratamento das RADs envolve a descontinuação imediata dos medicamentos suspeitos, o tratamento dos sintomas e medidas de suporte quando necessárias. Na anafilaxia, a epinefrina é o único medicamento comprovadamente eficaz e deve ser administrado prontamente. A dessensibilização ao medicamento deve ser considerada em pacientes com confirmação ou alta probabilidade de RAD por hipersensibilidade, em que seu uso for indispensável e outra opção não estiver disponível. A dessensibilização envolve a administração de um medicamento em doses crescentes até que a dose terapêutica seja atingida12. Se o tratamento com o alopurinol for necessário e a reação de hipersensibilidade inicial não for grave, a dessensibilização pode ser uma boa opção terapêutica13.
No presente relato, descrevemos uma dessensibilização oral ao alopurinol com um protocolo acelerado, garantindo em um curto intervalo de tempo um tratamento eficaz para pacientes que necessitam desta medicação.
Relato de caso
Um homem branco de 31 anos de idade, com diagnóstico de GSD-I, foi encaminhado ao nosso serviço após desenvolver um exantema maculopapular pruriginoso generalizado, uma hora após ingestão de 300 mg de alopurinol. Como o alopurinol é a única medicação disponível para o tratamento de hiperuricemia associada à doença de base, consideramos a dessensibilização ao medicamento como a melhor opção terapêutica para este paciente.
Inicialmente, foi proposta dessensibilização oral baseada em um protocolo com duração de 30 dias14 com a administração diária do medicamento, aumentando de 3 a 5 vezes a dosagem de um dia para o outro. A dose inicial foi de 0,01 mg, com o objetivo de alcançar 300 mg no trigésimo dia. Porém, com 1 mg de alopurinol, o paciente apresentou um leve eritema pruriginoso nas mãos e com 3 mg o quadro se estendeu para os pés. Julgando as reações como leves, optamos por continuar a progressão do protocolo. Ao atingir a dose de 100 mg, o paciente apresentou um exantema maculopapular, pruriginoso e generalizado, porém de leve intensidade. Uma semana após alcançar e manter a dose de 300 mg ao dia, houve piora do exantema e o paciente interrompeu o uso diário do alopurinol (Figuras 1 e 2). O exantema foi tratado com um curso de 21 dias de prednisona 60 mg ao dia associado a fexofenadina 180 mg duas vezes ao dia. Posteriormente, realizada retirada progressiva do corticoide sistêmico, sem intercorrências.
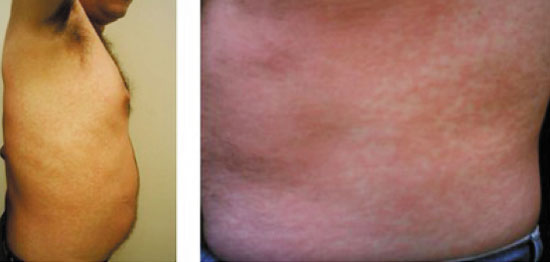
Figuras 1 e 2
Exantema maculopapular pruriginoso e generalizado após dose diária de 300 mg de alopurinol
No momento da realização desta dessensibilização, havia apenas descrição de um protocolo acelerado com alopurinol endovenoso15, porém esta apresentação já não estava mais comercialmente disponível. Portanto, foi optado por realizar uma adaptação, com administração da medicação via oral em ambiente hospitalar. O protocolo acelerado consistiu na administração de doses progressivas da medicação, com intervalo de 15 minutos entre elas, em que a dose inicial foi 0,01 mg e dose final alcançada foi de 100 mg, conforme apresentado na Figura 3.
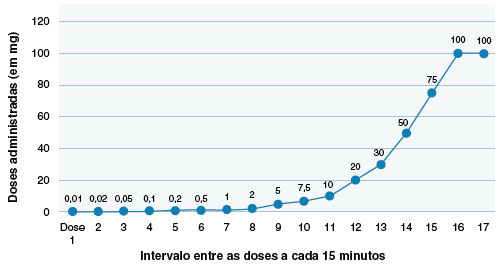
Figura 3
Protocolo acelerado de dessensibilização ao alopurinol
Inicialmente, o paciente foi orientado a manter alopurinol 300 mg ao dia, divididos em 3 doses (100 mg a cada 8 horas) no intuito de manter o intervalo entre as doses menor que 12 horas. Porém, algumas horas após, o paciente apresentou novamente exantema pruriginoso generalizado. Optado então por manter o alopurinol 100 mg a cada 8 horas em associação com prednisona 40 mg ao dia e cetirizina 10 mg duas vezes ao dia. Após 3 dias, o paciente apresentou resolução completa do exantema.
Após duas semanas do uso destas medicações, foi iniciada redução da dose da prednisona, com redução de 5 mg por semana. Ao alcançar 20 mg por dia de prednisona, o ritmo de redução foi de 2,5 mg por semana. Porém, ao atingir a dose 15/10 mg em dias alternados, houve novamente recidiva do exantema. Por este motivo, foi necessário aumentar a dose da prednisona para 40 mg ao dia por uma semana, em seguida 30 mg ao dia por mais uma semana e por fim, 20 mg ao dia por 2 semanas. A partir desta dose a redução foi no ritmo de 2,5 mg a cada 3 semanas. Após atingir 2,5 mg ao dia em dias alternados por 3 semanas, a prednisona foi suspensa. Dois meses após a cetirizina também foi suspensa.
Após a suspensão do corticoide e do anti-histamínico, o paciente não apresentou novas recidivas do exantema desde 2009. Tem feito uso de alopurinol 100 mg a cada 8 horas, sem a necessidade de associação de corticoides ou anti-histamínicos até o momento. Exames laboratoriais, incluindo hemograma e enzimas hepáticas, foram coletados periodicamente. O paciente não apresentou alterações destes exames antes, durante ou após o período da dessensibilização. A Figura 4 mostra as alterações articulares do paciente antes do início do tratamento, e a Figura 5 mostra a redução dos tofos gotosos após uso prolongado do alopurinol por este paciente.
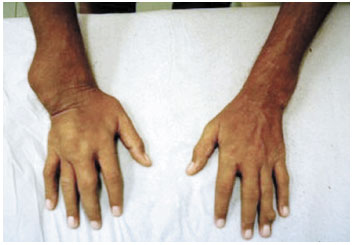
Figura 4
Alterações articulares antes do uso contínuo do alopurinol
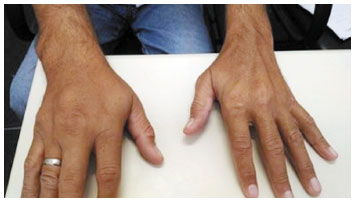
Figura 5
Redução dos tofos gotosos após uso prolongado de alopurinol
Discussão
A dessensibilização é um procedimento realizado com objetivo de reduzir temporariamente a hipersensibilidade, permitindo o uso de uma droga continuamente ou por um determinado tempo para completar um regime terapêutico16. Diferentes mecanismos podem estar relacionados à tolerância a drogas pela dessensibilização, como a inibição de haptenos, o consumo de IgE, a depleção de mediadores de mastócitos e basófilos e a dessensibilização de mastócitos17.
Embora a intolerância ao alopurinol seja pouco comum, aproximadamente 2% dos pacientes que usam este medicamento apresentam reações de hipersensibilidade. Apesar de novos medicamentos para o tratamento de hiperuricemia já terem sido desenvolvidos, estes são de difícil acesso em nosso meio, e assim, as escolhas ainda permanecem limitadas. Na maioria dos casos de pacientes com hipersensibilidade ao alopurinol a dessensibilização deve ser considerada, exceto para pacientes que apresentaram reações graves17. Para o paciente descrito neste relato, optamos por realizar a dessensibilização, visto que as reações apresentadas eram leves e não havia disponibilidade de tratamentos alternativos.
Na literatura, encontramos vários protocolos de dessensibilização com alopurinol, variando de 28 a 81 dias de duração, até que se atinja a dose terapêutica almejada. A duração mais prolongada dos protocolos tem como objetivo minimizar possíveis riscos, porém se houver urgência clínica, tais protocolos podem ser adaptados17.
No período da avaliação do paciente, havia apenas um relato de dessensibilização acelerada com alopurinol endovenoso (EV), porém esta apresentação da medicação não estava mais disponível comercialmente15. Baseado nisso, optou-se por realizar uma adaptação de um protocolo acelerado com o alopurinol EV, para a via oral. A administração da medicação via oral foi realizada em ambiente hospitalar supervisionado, sendo ofertado inicialmente a dose de 0,01 mg, com aumento progressivo em intervalos de 15 minutos, alcançando uma dose final de 100 mg em um único dia. O paciente foi orientado a manter dose de 100 mg a cada 8 horas, evitando o risco de ficar por um longo intervalo sem a dose atingida na dessensibilização.
Os protocolos para a dessensibilização empregam a administração de doses crescentes do medicamento com intervalos de tempo regulares para diminuir a frequência e a gravidade das reações. Ao longo do processo de dessensibilização, apesar de o paciente ter apresentado reações, nenhuma delas foi considerada grave. Além disso, a resposta ao tratamento instituído durante as reações leves foi adequada, o que permitiu manter a dessensibilização com segurança. Também foi levado em conta o impacto do não uso da medicação para tratamento da gota e o risco conhecido de acometimento de outros órgãos vitais18. Com base nestas considerações, manter a dessensibilização mostrou-se a melhor opção, apesar das reações. O protocolo foi posteriormente readaptado às necessidades do paciente, a fim de minimizar as reações e aumentar a tolerância, lançando mão de anti-histamínicos e corticoide sistêmico por um tempo suficiente, até atingir estabilidade clínica com o uso do alopurinol na dose desejada. Vale ressaltar ainda que a manutenção do uso regular e contínuo da droga é de fundamental importância para que não ocorra perda da tolerância induzida pela dessensibilização.
Com base na literatura, observamos que a maioria dos protocolos publicados para a dessensibilização oral ao alopurinol são lentos e graduais, sendo o protocolo oral de 28 dias o mais frequentemente utilizado e tolerado pelos pacientes. A dose de manutenção atingida neste protocolo é de 100 mg/dia13,19. Ao contrário do que se descreve nos trabalhos, o paciente relatado apresentou reação a baixas doses do alopurinol oral durante o protocolo longo, de 30 dias, inicialmente proposto14, sendo optado por iniciar o protocolo acelerado adaptado. Apesar de ainda ser pouco utilizada, a dessensibilização acelerada em ambiente hospitalar, ou mesmo ambulatorial quando adequado, deve ser considerada ponderando os riscos e benefícios relacionados a cada paciente de forma individualizada20.
Mais recentemente, foram publicados alguns relatos de indução de tolerância com alopurinol, por via oral, empregando protocolos com o objetivo de atingir a dose desejada em menor tempo. O tempo de duração da dessensibilização variou de 1 a 16 dias, sem aumento da frequência de reações17,21.
Conclusão
O tratamento da hiperuricemia é fundamental para evitar as complicações relacionadas às glicogenoses, trazendo maior qualidade de vida, redução das complicações metabólicas e cardiovasculares. Em pacientes intolerantes ao alopurinol e na indisponibilidade de tratamento alternativo, a dessensibilização deve ser considerada, e adaptações podem ser realizadas para que o melhor tratamento seja oferecido, desde que realizado em ambiente seguro e por equipe especializada. O protocolo acelerado de dessensibilização com alopurinol oral mostrou-se ser uma alternativa com bons resultados no caso descrito, mantendo o paciente com estabilidade clínica em curto e longo prazo.
Referências
1. Hannah WB, Derks TGJ, Drumm ML, Grünert SC, Kishnani PS, Vissing J. Glycogen storage diseases. Nat Rev Dis Primer. 2023;9:46.
2. Ozen H. Glycogen storage diseases: new perspectives. World J Gastroenterol. 2007;13:2541-53.
3. Kishnani PS, Austin SL, Abdenur JE, Arn P, Bali DS, Boney A, et al. Diagnosis and management of glycogen storage disease type I: a practice guideline of the American College of Medical Genetics and Genomics. Genet Med. 2014;16:e1-e29.
4. Yip K, Cohen RE, Pillinger MH. Asymptomatic hyperuricemia: is it really asymptomatic? Curr Opin Rheumatol. 2020;32:71-9.
5. Danve A, Sehra ST, Neogi T. Role of diet in hyperuricemia and gout. Best Pract Res Clin Rheumatol. 2021;35:101723.
6. Chou JY, Matern D, Mansfield BC, Chen Y-T. Type I glycogen storage diseases: disorders of the glucose-6-phosphatase complex. Curr Mol Med. 2002;2:121-43.
7. Wang C-W, Dao R-L, Chung W-H. Immunopathogenesis and risk factors for allopurinol severe cutaneous adverse reactions. Curr Opin Allergy Clin Immunol. 2016;16:339-45.
8. Halevy S, Ghislain P-D, Mockenhaupt M, Fagot J-P, Bouwes Bavinck JN, Sidoroff A, et al. Allopurinol is the most common cause of Stevens-Johnson syndrome and toxic epidermal necrolysis in Europe and Israel. J Am Acad Dermatol. 2008;58:25-32.
9. Jarjour S, Barrette M, Normand V, Rouleau JL, Dubé M-P, de Denus S. Genetic markers associated with cutaneous adverse drug reactions to allopurinol: a systematic review. Pharmacogenomics. 2015;16:755-67.
10. Pichler WJ. Immune pathomechanism and classification of drug hypersensitivity. Allergy. 2019;74:1457-71.
11. Pichler WJ. The important role of non-covalent drug-protein interactions in drug hypersensitivity reactions. Allergy. 2022;77:404-15.
12. Dykewicz MS, Lam JK. Drug Hypersensitivity Reactions. Med Clin North Am. 2020;104:109-28.
13. Fleisher TA. Practical Guidance for the Evaluation and Management of Drug Hypersensitivity: Introduction. J Allergy Clin Immunol Pract. 2020;8:S1-S2.
14. Fam AG, Dunne SM, Iazzetta J, Paton TW. Efficacy and safety of desensitization to allopurinol following cutaneous reactions. Arthritis Rheum. 2001;44:231-8.
15. Schumacher MJ, Copeland JG. Intravenous desensitization to allopurinol in a heart transplant patient with gout. Ann Allergy Asthma Immunol. 2004;92:374-6.
16. Calogiuri G, Nettis E, Di Leo E, Foti C, Ferrannini A, Butani L. Allopurinol hypersensitivity reactions: desensitization strategies and new therapeutic alternative molecules. Inflamm Allergy Drug Targets. 2013;12:19-28.
17. Dursun AB, Sahin OZ. Allopurinol desensitization with A 2 weeks modified protocol in an elderly patients with multiple comorbidities: a case report. Allergy Asthma Clin Immunol. 2014;10(1):52.
18. Chandratre P, Roddy E, Clarson L, Richardson J, Hider SL, Mallen CD. Health-related quality of life in gout: a systematic review. Rheumatology. 2013;52:2031-40.
19. Soares J, Caiado J, Lopes A, Pereira BM. Allopurinol Desensitization: A Fast or Slow Protocol? J Investig Allergol Clin Immunol. 2015;25:295-7.
20. Nitti F, Fumagalli M, Incorvaia C. Rush desensitization to allopurynol. Allergy. 2003;58:690.
21. Toker O, Tvito A, Rowe JM, Ashkenazi J, Ganzel C, Tal Y, et al. Rapid oral allopurinol desensitization in a patient with chronic myeloid leukemia. Isr Med Assoc J. 2014;16:461-2.



