Número Atual: Outubro-Dezembro 2023 - Volume 7 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
- Outros do Autor
Artigo Original
Determinação da reatividade cutânea às quinolonas e fatores associados
Cutaneous hypersensitivity to quinolones and associated factors
Wandilson Xavier Alves Junior, Marisa Ribeiro, Marcelo Vivolo Aun, Pedro Giavina-Bianchi
Disciplina de Imunologia Clínica e Alergia, Faculdade de Medicina da Universidade de São Paulo - São Paulo, SP, Brasil
Endereço para correspondência:
Wandilson Xavier Alves Junior
E-mail: wxavierjunior@gmail.com
Submetido em: 11/12/2023
Aceito em: 18/12/2023.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
INTRODUÇÃO: As quinolonas, amplamente usadas na prática clínica, correspondem à segunda causa de reações de hipersensibilidade aos antibióticos. Reações às quinolonas (RQ) são um desafio para o alergista, pois ocorrem por mecanismos IgE mediados, mas também por uma via não imunológica, o receptor MRGPRX2.
OBJETIVO: Este trabalho avalia a reatividade cutânea de pessoas sem alergia ao ciprofloxacino em diversas concentrações.
METODOLOGIA: Foram realizados prick tests (PT) e testes intradérmicos de leitura imediata (ID) com ciprofloxacino em voluntários atendidos em um ambulatório de serviço terciário. No PT, foram usadas concentrações de 2 mg/mL (solução mãe), 1:10 e 1:50. No ID, 1:10, 1:50, 1:100 e 1:500.
RESULTADOS: Foram incluídos 31 indivíduos sem histórico de RQ. A média de idade foi de 40,5 anos, sendo 74,1% do gênero feminino. Doenças atópicas foram encontradas em 48,4% dos participantes, 100% destes com rinite alérgica, 20% com conjuntivite alérgica, 13,3% com asma, e 13,3% com dermatite atópica. Uso prévio de quinolonas foi relatado por 45,2% dos indivíduos. O PT puro e 1:10 foi positivo em 25,8% e 6,5%, respectivamente; na concentração 1:50 não mostrou positividade. O ID 1:10, 1:50 e 1:100 foi positivo em 96,8%, 45,2% e 6,5%, respectivamente, mas foi negativo na diluição 1:500. Nos que já usaram quinolonas, o PT puro e 1:50 foram positivos em 28,6% e 14,3% dos participantes, respectivamente, versus 25% e 0% nos que não usaram. O ID entre os indivíduos que já usaram foi positivo em 100% na diluição 1:10, 57,1% na 1:50, e 14,3% na 1:100. Entre os que não usaram, 93,7% na diluição 1:10, 37,6% na 1:50, e 0% na 1:100. Nos atópicos, o PT foi positivo em 26,7% e 13,3% na concentração mãe e 1:10; e negativo em 1:50. Nos participantes não atópicos, observou-se positividade de 25% no PT com a solução mãe e testes negativos nas demais diluições. O ID com as soluções 1:10, 1:50 e 1:100 foi positivo em 100%, 46,7% e 6,7% dos atópicos, e 93,7%, 43,7%, 6,3% nos não atópicos, respectivamente.
CONCLUSÃO: O ciprofloxacino apresenta reatividade cutânea através de vias imunológicas e pelo MRGPRX2, sendo recomendada a realização de testes cutâneos em concentrações igual ou menores de 0,02 mg/mL para investigação de reações de hipersensibilidade imediata, pois essas concentrações apresentam boa especificidade.
Descritores: Alergia a quinolonas, testes cutâneos, teste de puntura, testes intradérmicos, ciprofloxacino.
Introdução
As quinolonas são drogas antibacterianas de amplo espectro. Inicialmente obtidas através da síntese da cloroquina, elas evoluíram quimicamente ao longo dos anos desde o surgimento do ácido nalidíxico, com ação predominante em bactérias gram-negativas do trato urinário, até os antibióticos modernos que penetram em vários sítios, têm maior espectro de ação e são usados para tratamento de microrganismos mais resistentes1.
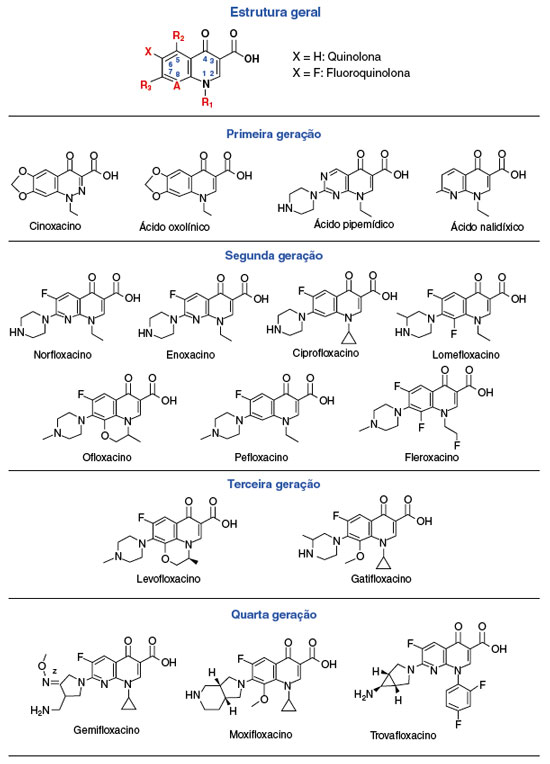
A estrutura química básica das quinolonas consiste em um anel 4-oxo-1,4-dihidroquinoleino, com um átomo de hidrogênio na posição 1 e um ácido carboxílico nas posições 3 e 4. Desde a síntese da primeira quinolona, várias mudanças químicas foram realizadas, melhorando a eficácia, o espectro de ação, a atividade bactericida e a penetração tecidual. As quinolonas são classificadas em quatro gerações de acordo com a estrutura química e o espectro antibacteriano. A estrutura química das quinolonas e sua classificação estão demonstradas na Figura 12.
A primeira geração de quinolonas- ácido nalidíxico, ácido pipemídico, cinoxacino, ácido oxolínico- possui atividade contra bactérias gram-negativas e penetração restrita ao trato urinário. A segunda geração, gerada a partir da introdução de um átomo de flúor na posição C-6, corresponde às fluoroquinolonas (ciprofloxacino, norfloxacino, ofloxacino, pefloxacino, fleroxacino, lomefloxacino, enoxacino), e possui ampla atividade contra bactérias gram-negativas e maior potência contra gram-positivas. A adição de um halogênio (flúor ou cloro) à posição 8 levou às quinolonas de terceira geração- levofloxacino e gatifloxacino- com maior atividade contra Pseudomonas aeruginosa, bactérias gram-positivas e anaeróbias. Por fim, a quarta geração- moxifloxacino, gemifloxacino e trovafloxacino- é mais potente contra bactérias gram-positivas e anaeróbias, com menor ação contra P. aeruginosa devido a presença de um anel duplo derivado do anel de pirrolidona na posição 7, e um grupo metoxi na posição 83,4.
As quinolonas têm sua ação bactericida ao agir nas enzimas bacterianas DNA girase e DNA topoisomerase IV, inibindo a replicação do microorganismo1,4,5. Atualmente, são antibióticos amplamente usados para o tratamento de bactérias gram-positivas e gram-negativas, envolvendo os tratos urinário, respiratório, digestivo e cutâneo, além de infecções sexualmente transmissíveis, prostatite e tuberculose5.
Devido ao seu amplo uso, eventos adversos com o uso destas medicações vêm sendo descritos. As reações adversas a medicamentos (RAM) são definidas pela Organização Mundial da Saúde (OMS) como "qualquer efeito não terapêutico decorrente do uso de um fármaco nas doses habitualmente empregadas para prevenção, diagnóstico ou tratamento de doenças". São reações não desejadas e não intencionadas. Elas são classificadas em tipo A- previsíveis e dose-dependente; e tipo B- não previsíveis, dose-independente, não associadas diretamente ao efeito do fármaco6.
As reações de hipersensibilidade (RH) a medicamentos são definidas pela OMS como RAM do tipo B que se assemelham a alergia, sendo reprodutíveis em administrações subsequentes. O termo alergia a medicamentos deve ser usado quando há um mecanismo imunológico específico associado às manifestações clínicas, seja com o envolvimento de imunoglobulinas específicas ou de células T6.
As RHs às quinolonas são a segunda causa de hipersensibilidade a antibióticos e a terceira a medicamentos de maneira geral, ficando atrás dos anti-inflamatórios não esteroidais e dos betalactâmicos em frequência7. Elas são classificadas como imediatas, que geralmente envolvem a urticária e outros sintomas associados à anafilaxia, ou reações tardias mediadas por células T como o exantema maculopapular, reação a drogas com eosinofilia e sintomas sistêmicos (DRESS - drug reaction with eosinophilia and systemic symptoms), ou a pustulose exantemática generalizada aguda (PEGA)2,8.
As RHs imediatas às quinolonas, decorrente da ativação de mastócitos e basófilos, podem ocorrer por endótipos diferentes, apesar de compartilharem o mesmo fenótipo. A presença de IgE específica para quinolonas foi identificada em 30 a 55% dos indivíduos com histórico de RH imediatas8-10, porém em alguns indivíduos estes medicamentos podem desencadear reações por outros mecanismos, como sendo agonistas do receptor MRGPRX2 (mast-related G-protein receptor X2), presente em mastócitos, basófilos e eosinófilos, levando à ativação dessas células2,11.
O diagnóstico das RHs imediatas às quinolonas, na prática, baseia-se na história clínica detalhada dos sintomas apresentados e do uso prévio da medicação envolvida, que se correlaciona com a reação na linha do tempo. Exames adicionais, como testes cutâneos e o teste de provocação, são ferramentas importantes na investigação. Testes in vitro, como a pesquisa da IgE específica e o teste de ativação de basófilos, apesar de pouco disponíveis e com maior aplicação nas pesquisas, podem ser utilizados2,12,13.
A investigação com testes cutâneos inicia-se com o prick test ou teste de puntura. Nos casos de resultado negativo, prossegue-se com a realização do intradérmico de leitura imediata. Apesar de amplamente utilizados na prática clínica de RHs a outras classes de medicamentos, o uso dos testes cutâneos é controverso para as quinolonas, haja vista que estas drogas podem gerar resultados positivos por dois mecanismos- presença de IgE específica e ação agonista no receptor MRGPRX2, a depender da concentração usada2,14.
A determinação da diluição do medicamento a ser utilizada nos testes cutâneos é essencial. Soluções mais concentradas podem induzir reações cutâneas "irritativas" em indivíduos sem histórico de RH, ou, no caso das quinolonas, através do receptor MRGPRX2 presente nos mastócitos da pele. Portanto, o valor preditivo positivo dos testes cutâneos deve ser interpretado à luz das possíveis interferências.
Além das concentrações utilizadas na realização dos testes cutâneos, outras condições podem influenciar os resultados, como a reatividade cutânea, a presença de comorbidades, e o uso de medicamentos anti-histamínicos e antidepressivos tricíclicos. Desta forma, o conhecimento da reatividade cutânea em diferentes concentrações usadas nos testes cutâneos com as quinolonas, associado à análise de possíveis fatores interferentes, podem auxiliar no melhor entendimento da homeostase mastocitária, além de potencialmente predizer a diluição mais adequada para a propedêutica das RH imediatas às quinolonas.
Este trabalho teve como objetivo geral a avaliação da reatividade aos testes cutâneos, epicutâneos (prick test) e intradérmico de leitura imediata, às quinolonas em uma população sem histórico de hipersensibilidade a estes fármacos. O estudo possibilitou a determinação de concentração do ciprofloxacino que apresenta boa especificidade nos testes cutâneos para investigação de reações imediatas ao antibiótico. Como objetivo secundário, o estudo analisou possíveis fatores associados à reatividade da pele ao ciprofloxacino nos testes cutâneos de leitura imediata.
Metodologia
Este trabalho consistiu em uma avaliação transversal e analítica da população estudada, formada por indivíduos sem história de reação de hipersensibilidade imediata às quinolonas. Foram selecionados voluntários adultos, acima de 18 anos, atendidos nos ambulatórios do Serviço de Imunologia Clínica e Alergia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo.
Foram excluídas as pessoas com histórico de hipersensibilidade prévia a quinolonas, em uso de anti-histamínicos nos últimos 7 dias prévios à realização do teste cutâneo, a presença de anafilaxia em qualquer momento da vida, síndrome de ativação mastocitária, mastocitose cutânea ou sistêmica, urticária crônica espontânea ou induzida, e doença de pele extensa que impossibilitasse a realização de testes cutâneos.
Inicialmente, foi realizada entrevista para coleta de histórico médico- idade, sexo, uso prévio de quinolonas, presença de doenças atópicas, histórico pessoal ou familiar de hipersensibilidade a outras medicações. Em seguida, foram executados prick test para avaliar a sensibilização para aeroalérgenos com extratos de Dermatophagoides pteronyssinus, Blomia tropicalis, epitélio de cão e gato, Lolium perenne, Aspergillus sp., Penicillium notatum, Blatella germanica e Periplaneta americana.
Por fim, foi avaliada a reatividade cutânea ao ciprofloxacino. O teste de puntura foi realizado nas concentrações 2 mg/mL (solução pura), 0,2 mg/mL (1:10) e 0,04 mg/mL (1:50). O intradérmico de leitura imediata foi executado nas concentrações 0,2 mg/mL (1:10), 0,04 mg/mL (1:50), 0,02 mg/mL (1:100) e 0,0004 mg/mL (1:500). O prick test foi considerado positivo se houvesse a formação de pápula maior de 3 mm do controle negativo (solução salina). No intradérmico, se houvesse diferença nos tamanhos da pápula inicial com a pápula final de 3 mm a mais da diferença observada no controle negativo, o teste era positivo. Os testes cutâneos foram realizados em duplicata na face anterior de ambos os antebraços.
A análise estatística foi conduzida usando a plataforma Python, com dados fornecidos em arquivos Excel®. Os dados coletados incluíam características dos pacientes e resultados dos testes, que foram convertidos para valores binários. Todas as variáveis contínuas foram expressas como médias e seus desvios padrão. Foi realizada análise descritiva inicial, seguida da aplicação do teste t de Student para amostras não pareadas. As variáveis categóricas foram apresentadas como números e porcentagem, e comparadas pelo teste Qui-quadrado (χ2). Valores de p inferiores a 0,05 foram considerados significativos. Os gráficos de barras foram gerados usando Matplotlib e Seaborn.
Resultados
Neste estudo foram incluídos 31 indivíduos sem histórico de hipersensibilidade às quinolonas. A idade média foi de 40,5 anos (desvio padrão de 13,0 anos) e 74,1% eram do sexo feminino. Doenças atópicas foram relatadas em 48,4%- dentre elas, 100% de rinite alérgica, 20% de conjuntivite alérgica, 13,3% de asma e 13,3% de dermatite atópica. Do total de participantes, 45,2% relataram uso prévio de quinolonas; destes, 32,2% tiveram contato com ciprofloxacino, 32,2% com levofloxacino e 0,03% com moxifloxacino. Estes dados estão descritos na Tabela 1. A distribuição das idades está demonstrada na Figura 2.

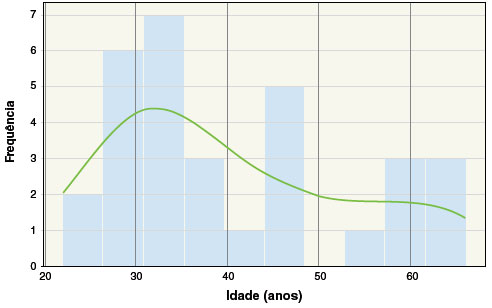
Figura 2
Distribuição de idade na população analisada
Na população total, o prick test com a solução pura e 1:10 foi positivo em 25,8% e 6,5%, respectivamente; na concentração 1:50 não mostrou positividade. O teste intradérmico nas concentrações 1:10, 1:50 e 1:100 foi positivo em 96,8%, 45,2% e 6,5%, respectivamente. Não houve resultados positivos para a concentração 1:500. Portanto, ambas as especificidades do prick test na diluição 1:10 e do teste intradérmico 1:100 foram de 93,5%.
O prick test para aeroalérgenos foi positivo em 54,9% dos avaliados. Nestes, a puntura com ciprofloxacino foi positiva em 23,5% e 11,8% nas soluções pura e 1:10, respectivamente. O teste intradérmico com o antibiótico foi positivo em 100%, 52,9% e 5,8% nas concentrações 1:10, 1:50 e 1:100, respectivamente. Portanto, a concentração de 1:100 apresentou boa especificidade, de 94,2% nos indivíduos com atopia.
Os pacientes com resultado negativo para os aeroalérgenos corresponderam a 45,1%, nos quais 28,6% foram positivos no prick test com ciprofloxacino puro, mas negativos nas demais concentrações. No teste intradérmico com ciprofloxacino, foi positivo em 99,9%, 35,8% e 7,2% nas concentrações 1:10, 1:50, 1:100, respectivamente.
Os resultados dos testes Qui-quadrado para cada tipo e diluição de teste cutâneo com ciprofloxacino, comparando indivíduos com resultados positivos e negativos no teste para aeroalérgenos, não mostrou diferenças estatísticas.
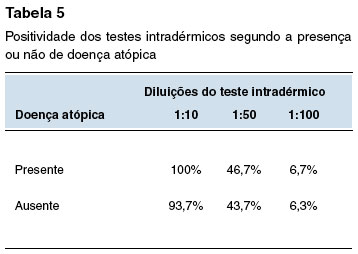
No subgrupo de voluntários com doenças atópicas, o teste de puntura foi positivo em 26,7% e 13,3% na concentração pura e 1:10, respectivamente. O teste intradérmico 1:10, 1:50 e 1:100 foi positivo em 100%, 46,7% e 6,7%, respectivamente.
Entre os participantes sem doenças atópicas, 25% apresentaram o prick test com a solução pura positivo, sendo negativo nas demais concentrações. O teste intradérmico 1:10, 1:50 e 1:100 foi positivo 93,7%, 43,7%, 6,3% nos participantes não atópicos.
Na avaliação dos testes Qui-quadrado para os testes cutâneos com ciprofloxacino e a presença ou não de doenças atópicas, não foram observadas diferenças estatísticas.
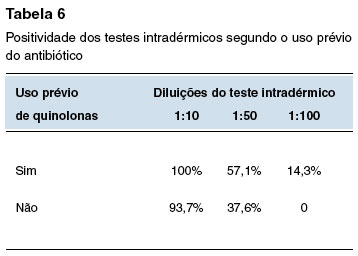
Na população que relatou uso prévio de quinolonas, o prick test com a solução pura e 1:10 foram positivos 28,6% e 14,3%, respectivamente, versus 25% e 0% nos que não usaram. O teste intradérmico 1:10, 1:50 e 1:100 entre os que já usaram o antibiótico foi positivo em 100%, 57,1% e 14,3%, respectivamente. Entre os que não usaram, o teste intradérmico com as concentrações 1:10, 1:50 e 1:100 foi positivo em 93,7%, 37,6% e 0%, respectivamente.
Os resultados dos testes de Qui-quadrado comparando o uso prévio de quinolonas revelaram p = 0,3 para o prick test com a solução pura e 1:10, e p = 0,9, p = 0,4 e p = 0,2 para os testes intradérmicos com 1:10, 1:50 e 1:100, respectivamente.
Dentre todos os voluntários, 74,2% negaram RAM prévia a qualquer medicamento, sendo o prick test com a solução pura e 1:10 positivo em 26,0% e 4,3%, e o teste intradérmico 1:10, 1:50 e 1:100 apresentou reatividade cutânea em 95,6%, 52,1% e 4,3%, respectivamente.
Os participantes que relataram RAM tipo A ou B corresponderam a 25,8%, dos quais 25,0% e 12,5% apresentaram reatividade cutânea ao prick test com a solução pura e 1:10, respectivamente. Quando avaliados com o teste intradérmico em 1:10, 1:50 e 1:100, houve reatividade em 100%, 25% e 12,5%, respectivamente.
O testes Qui-quadrado não mostrou diferenças estatisticamente significantes entre os testes cutâneos dos participantes com e sem a presença de RAM prévia.
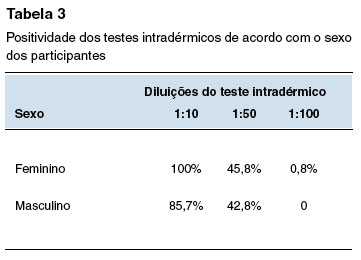
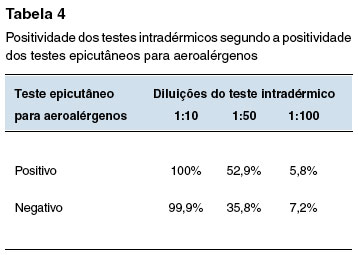
A Tabela 2 mostra a positividade dos testes cutâneos na população geral do estudo e segundo fatores associados: teste epicutâneo para aeroalérgenos positivo; presença de doença atópica; uso prévio de quinolonas; e história prévia de reação a medicamentos. As Tabelas 3, 4, 5 e 6 comparam a positividade dos testes intradérmicos segundo quatro fatores associados: sexo, teste epicutâneo para aeroalérgenos positivo, presença de doença atópica, e uso prévio de quinolonas.
Discussão
As reações de hipersensibilidade (RH) a medicamentos, alérgicas ou não, são subdiagnosticadas em alguns cenários, mas também podem ser atribuídas em excesso aos pacientes, trazendo diagnósticos equivocados de alergias a indivíduos hígidos. Isto acarreta em prejuízos nas abordagens terapêuticas futuras, nas quais fármacos menos eficazes e de custo mais elevado são utilizados como alternativas6,15.
A realização de testes cutâneos para antibióticos betalactâmicos já está bem estabelecida, assim como algoritmos para definir qual a porção da molécula com maior probabilidade de estar envolvida na sensibilização. Para as quinolonas, a aplicabilidade dos testes parece ser mais controversa, uma vez que as concentrações para testes não estão bem estabelecidas, podendo os testes serem positivos por vias imunológicas e não imunológicas (irritativas).
As RH a quinolonas, antibióticos de amplo espectro e utilizados em diversas condições clínicas, são de difícil investigação. Neste trabalho, um número considerável de indivíduos sem histórico de RAM a estes medicamentos apresentou reatividade cutânea ao ciprofloxacino em diferentes concentrações. Este resultado reflete a dificuldade prática em realizar a investigação das RH para estas medicações.
Broz e cols. avaliaram a reatividade cutânea com ciprofloxacino através do teste intradérmico nas concentrações 1:300, 1:1000 e 1:3000 em 15 voluntários sem histórico de RH a quinolonas. A leitura dos testes foi realizada através de registro fotográfico e análise da progressão da pápula por software computacional, além da aplicação de fluxometria de Laser Doppler a fim de avaliar alterações na perfusão da pele. Para a concentração de 1:300, não foi observado progressão da pápula, apesar de aumento do fluxo sanguíneo, sendo no final considerada concentração não irritativa16.
Venturini Díaz e cols. utilizaram ciprofloxacino na concentração 0,02 mg/mL (1:100) para teste de puntura e intradérmico, levofloxacino em 5 mg/mL para o prick test e 0,05 mg/mL no intradérmico, e outras quinolonas de apresentação oral (norfloxacino, ofloxacino, moxifloxacino, ácido pipemídico, travofloxacino) em tablets diluídos em solução salina para prick test, em 12 indivíduos sem RH a quinolonas. Destes, 3 participantes tiveram prick test positivo para ofloxacino, 1 para moxifloxacino e 1 para ácido pipemídico17.
Em nosso trabalho, tanto o prick test 1:10 quanto o intradérmico 1:100 apresentaram especificidade de 93,5%, sendo as concentrações mais recomendadas para testes cutâneos para excluir hipersensibilidade a esta medicação. O uso prévio de quinolonas e RAM a outra medicação tiveram índices maiores de positividade na concentração 1:100, podendo sugerir alguma sensibilização prévia, entretanto a diferença não foi estatisticamente significante. A atopia ou a presença de doenças atópicas não interferiram nos resultados dos testes cutâneos.
Na literatura médica, não há consenso atual sobre o uso dos testes cutâneos na abordagem das RH a quinolonas, havendo autores favoráveis, assim como desfavoráveis, os quais recomendam a realização apenas do teste de provocação, procedimento que não é isento de risco18,15.
Por conta destas limitações, pouco se realizam os testes cutâneos em indivíduos com histórico de hipersensibilidade, levando a uma escassez de dados sobre a sua sensibilidade nos indivíduos submetidos ao teste de provocação, abrindo possibilidade para estudos futuros.
Conclusão
Em nosso trabalho, o prick test 1:10 e o intradérmico 1:100 apresentaram especificidade de 93,5%, sendo as concentrações recomendadas para testes cutâneos para excluir hipersensibilidade a esta medicação. Indivíduos com uso prévio de quinolonas ou RAM para outras medicações tiveram tendência de maior reatividade em menores concentrações, entretanto, mais estudos são necessários para definir a sensibilidade dos testes cutâneos e a sua aplicabilidade clínica.
Referências
1. Naeem A, Badshah SL, Muska M, Ahmad N, Khan K. The Current Case of Quinolones: Synthetic Approaches and Antibacterial Activity. Molecules. 2016 Mar 28;21(4):268.
2. Doña I, Blanca-López N, Boteanu C, Cueva-Oliver B, Fernández-Sánchez FJ, Gajate P, et al. Clinical Practice Guidelines for Diagnosis and Management of Hypersensitivity Reactions to Quinolones. J Investig Allergol Clin Immunol. 2021 Jul 26;31(4):292-307.
3. Dalhoff A, Schmitz FJ. In vitro antibacterial activity and pharmacodynamics of new quinolones. Eur J Clin Microbiol Infect Dis. 2003 Apr;22(4):203-21.
4. Sousa J, Alves G, Fortuna A, Falcão A. Third and fourth generation fluoroquinolone antibacterials: a systematic review of safety and toxicity profiles. Curr Drug Saf. 2014;9(2):89-105.
5. Bush NG, Diez-Santos I, Abbott LR, Maxwell A. Quinolones: Mechanism, Lethality and Their Contributions to Antibiotic Resistance. Molecules. 2020 Dec 1;25(23):5662.
6. Demoly P, Adkinson NF, Brockow K, Castells M, Chiriac AM, Greenberger PA, et al. International Consensus on drug allergy. Allergy. 2014 Apr;69(4):420-37.
7. Doña I, Moreno E, Pérez-Sánchez N, Andreu I, Hernández Fernandez de Rojas D, Torres MJ. Update on Quinolone Allergy. Curr Allergy Asthma Rep. 2017 Aug;17(8):56.
8. Scherer K, Bircher AJ. Hypersensitivity reactions to fluoroquinolones. Curr Allergy Asthma Rep. 2005 Jan;5(1):15-21.
9. Aranda A, Mayorga C, Ariza A, Doña I, Rosado A, Blanca-Lopez N, Andreu I, Torres MJ. In vitro evaluation of IgE-mediated hypersensitivity reactions to quinolones. Allergy. 2011 Feb;66(2):247-54.
10. Manfredi M, Severino M, Testi S, Macchia D, Ermini G, Pichler WJ, et al. Detection of specific IgE to quinolones. J Allergy Clin Immunol. 2004 Jan;113(1):155-60.
11. Elst J, Maurer M, Sabato V, Faber MA, Bridts CH, Mertens C, Van Houdt M, et al. Novel Insights on MRGPRX2-Mediated Hypersensitivity to Neuromuscular Blocking Agents And Fluoroquinolones. Front Immunol. 2021 Jul 27;12:668962.
12. Doña I, Torres MJ, Montañez MI, Fernández TD. In Vitro Diagnostic Testing for Antibiotic Allergy. Allergy Asthma Immunol Res. 2017 Jul;9(4):288-98.
13. Giavina-Bianchi P, Gonçalves DG, Zanandréa A, Borges de Castro R, Garro LS, Kalil J, et al. Anaphylaxis to quinolones in mastocytosis: Hypothesis on the mechanism. J Allergy Clin Immunol Pract. 2019 Jul-Aug;7(6):2089-90.
14. McNeil BD, Pundir P, Meeker S, Han L, Undem BJ, Kulka M, et al. Identification of a mast-cell-specific receptor crucial for pseudo-allergic drug reactions. Nature. 2015 Mar 12;519(7542):237-41.
15. Kitsos N, Cassimos D, Xinias I, Agakidis C, Mavroudi A. Management of antibiotic allergy in children: a practical approach. Allergol Immunopathol (Madr). 2022 Sep 1;50(5):30-8.
16. Broz P, Harr T, Hecking C, Grize L, Scherer K, Jaeger KA, et al. Nonirritant intradermal skin test concentrations of ciprofloxacin, clarithromycin, and rifampicin. Allergy. 2012 May;67(5):647-52.
17. Venturini Díaz M, Lobera Labairu T, del Pozo Gil MD, Blasco Sarramián A, González Mahave I. In vivo diagnostic tests in adverse reactions to quinolones. J Investig Allergol Clin Immunol. 2007;17(6):393-8.
18. Blanca-López N, Andreu I, Torres Jaén MJ. Hypersensitivity reactions to quinolones. Curr Opin Allergy Clin Immunol. 2011 Aug;11(4):285-91.