Número Atual: Outubro-Dezembro 2023 - Volume 7 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Filipe Wanick Sarinho
- Norma de Paula Motta Rubini
- Aldo José Fernandes Costa
- Eduardo Costa de Freitas Silva
- Fabrício Prado Monteiro
- Faradiba Sarquis Serpa
- Marta de Fátima Rodrigues da Cunha Guidacci
- Martti Anton Antila
- Nelson Guilherme Bastos Cordeiro
- Rosana Câmara Agondi
- Sérgio Duarte Dortas Júnior
- Régis de Albuquerque Campos
- Ekaterini Simões Goudouris
- Fábio Chigres Kuschnir
- João Negreiros Tebyriçá
- Nelson Augusto Rosário Filho
ARTIGO ESPECIAL
Guia prático para o uso de imunobiológicos em doenças alérgicas - ASBAI
Practical guide for the use of immunobiologic agents in allergic diseases - ASBAI
Filipe Wanick Sarinho1,2; Norma de Paula Motta Rubini3,4; Aldo José Fernandes Costa5,2; Eduardo Costa de Freitas Silva6,2; Fabrício Prado Monteiro7,2; Faradiba Sarquis Serpa8,9; Marta de Fátima Rodrigues da Cunha Guidacci10,2; Martti Anton Antila11,2; Nelson Guilherme Bastos Cordeiro12,13; Rosana Câmara Agondi14,15; Sérgio Duarte Dortas Júnior16,2; Régis de Albuquerque Campos17,18; Ekaterini Simões Goudouris19,20; Fábio Chigres Kuschnir21,22; João Negreiros Tebyriçá23,2; Nelson Augusto Rosário Filho24,2
1. Professor Assistente da Universidade Federal de Pernambuco (UFPE) - Centro de Pesquisa em Alergia e Imunologia (HC-UFPE)
2. Membro do Departamento Científico de Imunobiológicos da Associação Brasileira de Alergia e Imunologia (ASBAI)
3. Professora Titular Emérita de Alergia e Imunologia da Escola de Medicina e Cirurgia da Universidade Federal do Estado do Rio de Janeiro (UNIRIO)
4. Coordenadora do Departamento Científico de Imunobiológicos da ASBAI
5. Doutor em Nutrição pela Universidade Federal de Pernambuco (UFPE)
6. Doutor em Medicina pela Universidade do Estado do Rio de Janeiro (UERJ)
7. Professor Assistente de Imunologia e Genética da Faculdade de Medicina da Universidade Vila Velha
8. Professora da Escola Superior de Ciências da Santa Casa de Misericórdia de Vitória (EMESCAM)
9. Membro do Departamento Científico de Asma da ASBAI
10. Médica da Secretaria de Saúde do Distrito Federal
11. Médico Preceptor dos Programas de Residência Médica em Dermatologia, Pediatria e Otorrinolaringologia da Pontifícia Universidade Católica de São Paulo
12. Professor do Curso de Pós-Graduação em Alergia e Imunologia do Hospital Central de Exército (HCE)/UNIFASE
13. Membro do Departamento Científico de Dermatite Atópica da ASBAI
14. Doutora em Ciências pela Faculdade de Medicina da Universidade de São Paulo (USP)
15. Membro do Departamento Científico de Urticária da ASBAI
16. Médico do Serviço de Imunologia Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (UFRJ)
17. Professor Associado da Faculdade de Medicina da Universidade Federal da Bahia (UFBA)
18. Coordenador do Departamento Científico de Urticária da ASBAI
19. Professora do Departamento de Pediatria da Faculdade de Medicina da Universidade Federal do Rio de Janeiro (UFRJ)
20. Diretora Científica da ASBAI
21. Professor Associado do Departamento de Pediatria da Faculdade de Ciências Médicas da Universidade do Estado do Rio de Janeiro (UERJ)
22. Presidente da ASBAI
23. Professor Livre Docente em Alergia e Imunologia pela Universidade Federal do Estado do Rio de Janeiro (UNIRIO)
24. Professor Titular de Pediatria da Universidade Federal do Paraná (UFPR)
Endereço para correspondência:
Filipe W. Sarinho
E-mail: filipe.sarinho@ufpe.br
Submetido em: 30/11/2023
Aceito em: 14/12/2023.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
Os anticorpos monoclonais são uma nova classe de medicamentos que representa um marco na evolução da terapia de doenças alérgicas graves. Além de possibilitar uma terapia imunológica alvo específico, proporciona maior controle de sintomas, redução de exacerbações, melhoria da qualidade de vida e da segurança. A eficácia e a segurança dos anticorpos monoclonais no tratamento de doenças alérgicas estão bem documentadas nos estudos clínicos pivotais, de extensão e de vida real. No Brasil, estão licenciados atualmente pela Agência Nacional de Vigilância Sanitária (ANVISA) imunobiológicos para asma, dermatite atópica (DA), esofagite eosinofílica (EoE), granulomatose eosinofílica com poliangeíte (GEPA), rinossinusite crônica com pólipo nasal (RSCcPN), síndromes hipereosinofílicas (SHE) e urticária crônica espontânea (UCE). Com a incorporação do uso dessas novas terapias no dia a dia do médico alergologista e imunologista, naturalmente emergem aspectos práticos que exigem orientações práticas perante as evidências científicas mais atuais, a fim de se manter a boa prática médica, com uso criterioso e consciente pelo especialista capacitado. Assim, nesse guia prático, abordaremos os imunobiológicos aprovados até o momento para doenças alérgicas graves, com objetivo de auxiliar o especialista em Alergia e Imunologia na prescrição e manejo dessas medicações, incluindo indicações, contraindicações, monitoramento da eficácia e segurança, notificação de eventos adversos, bem como aspectos associados aos cuidados com vacinas, populações especiais, acesso, transporte, armazenamento e aplicação domiciliar.
Descritores: Anticorpos monoclonais, asma, urticária, dermatite atópica, esofagite eosinofílica, pólipos nasais.
Introdução
Os avanços na compreensão da patogênese das doenças alérgicas e a identificação de fenótipos e endótipos, em paralelo ao desenvolvimento de terapias alvo, possibilitou a aplicação do conceito de medicina de precisão no tratamento de pacientes com doenças alérgicas graves. Paralelamente ao desenvolvimento desse conhecimento, diversos aspectos práticos impactam a incorporação do uso dessas novas terapias no dia a dia do médico Alergologista e Imunologista.
Os imunobiológicos são moléculas de alto peso molecular com estrutura complexa, produzidas em organismos ou cultura de células vivas, e que atuam no sistema imune, compreendendo várias classes; vacinas, soros, imunoglobulinas, anticorpos monoclonais, proteínas de fusão e citocinas humanas. Nesse guia, abordaremos os anticorpos monoclonais, que são a classe mais recente e com maior uso nas doenças alérgicas graves1,2. Atualmente, os anticorpos monoclonais constituem uma classe de medicamentos em contínua expansão e estão licenciados pela ANVISA no Brasil para as seguintes condições: asma, dermatite atópica (DA), esofagite eosinofílica (EoE), granulomatose eosinofílica com poliangeíte (GEPA), rinossinusite crônica com pólipo nasal (RSCcPN), síndromes hipereosinofílicas (SHE) e urticária crônica espontânea (UCE). Dentre os fármacos licenciados no país, no âmbito do Sistema Único de Saúde (SUS), somente o omalizumabe e o mepolizumabe estão disponíveis para o tratamento da asma grave3. Na saúde suplementar, estão incorporados no Rol de Procedimentos da Agência Nacional de Saúde (ANS) quatro imunobiológicos: omalizumabe, mepolizumabe, benralizumabe e dupilumabe, compreendendo várias indicações4. O tezepelumabe foi licenciado pela ANVISA em 2022 para o tratamento adicional de pacientes com asma grave e não está incorporado, até o presente, para uso no SUS e na saúde suplementar.
A eficácia e a segurança dos anticorpos monoclonais no tratamento de doenças alérgicas estão bem documentadas nos estudos clínicos pivotais e de extensão. Além disso, foram realizados estudos de vida real para a maioria dos biológicos e condições alérgicas. A ampliação do uso na prática clínica necessita ser criteriosa, com supervisão de médico capacitado, monitoramento durante a aplicação e avaliação contínua da resposta ao tratamento, bem como da ocorrência de potenciais eventos adversos5,6.
Esse guia prático tem o objetivo de auxiliar o especialista em Alergia e Imunologia com relação à prescrição de imunobiológicos, incluindo: indicações, contraindicações, monitoramento da eficácia e segurança, notificação de eventos adversos, bem como aspectos práticos dos cuidados no transporte, armazenamento e aplicação.
Biológicos
Omalizumabe
Mecanismo de ação
O omalizumabe é um anticorpo monoclonal IgG1 humanizado, cujo principal mecanismo de ação é a neutralização da IgE circulante. Esse imunobiológico liga-se especificamente à porção Cε3 da molécula de IgE livre circulante e, desse modo, impede a ligação desta aos seus receptores FcεRI e CD23 na superfície de mastócitos, basófilos e outros tipos de células. Conforme demonstrado em vários estudos, como resultado da formação dos complexos omalizumabe-IgE na circulação, observa-se a redução da expressão do FcεRI na superfície dos mastócitos e basófilos, com redução da ativação e da desgranulação destas células efetoras e da produção de IgE. Como consequência, há inibição do recrutamento de células inflamatórias para o tecido alvo, especialmente, os eosinófilos e, portanto, o uso do omalizumabe minimiza a cascata inflamatória de perfil T2 que caracteriza a patogênese da asma alérgica7-9.
O omalizumabe também proporciona uma redução no número de um subtipo de células dendríticas que estão aumentadas nas exacerbações da asma, contribuindo para controle da inflamação Tipo 2. Além disso, existem evidências de que pacientes tratados com omalizumabe produzem mais IFN-α em resposta a infecções por rinovírus e influenza, o que poderia estar associado à redução do número de exacerbações desencadeadas por esses agentes infecciosos10.
O omalizumabe é eficaz na asma alérgica grave, pois promove redução do número de exacerbações, controle de sintomas, melhora da qualidade de vida, diminuição do uso de corticosteroide oral e melhora da função pulmonar11.
Na rinossinusite crônica com pólipo nasal, esse imunobiológico demonstrou eficácia na redução do tamanho dos pólipos, assim como no melhor controle de sintomas e qualidade de vida12.
A urticaria crônica espontânea (UCE) é considerada atualmente como uma doença autoimune, na qual se observa a presença de autoanticorpos IgG anti-FcεRI ou IgG anti-IgE (autoimunidade tipo IIb) produzindo degranulação dos mastócitos. Outro mecanismo descrito consiste na presença de autoanticorpos da classe IgE contra autoalérgenos (autoimunidade tipo I). O omalizumabe exerce seus efeitos por meio da redução do nível da IgE sérica, o que diminui a ligação com autoanticorpos da classe IgG anti IgE, assim como reduz os níveis de autoanticorpos da classe IgE. Além disso, ocorre redução da expressão do receptor FcεRI nos mastócitos cutâneos e em basófilos, diminuindo, por conseguinte, a ativação dessas células e reduzindo a ação de autoanticorpos IgG anti-FcεRI13-15. A eficácia do omalizumabe na UCE foi demonstrada através da redução do aparecimento das urticas e do angioedema, do prurido cutâneo e melhora significativa da qualidade de vida13.
Indicações e contraindicações
O omalizumabe é indicado como tratamento complementar para adultos e crianças (acima de 6 anos de idade) com asma alérgica persistente, moderada a grave, cujos sintomas são inadequadamente controlados com corticosteroides inalatórios (CI). Outras duas indicações incluem o tratamento complementar para adultos (acima de 18 anos) com rinossinusite crônica com pólipo nasal (RSCcPN) nos quais o tratamento com corticosteroides intranasais não tenha promovido o controle adequado da doença; e o tratamento adicional para pacientes adultos e adolescentes acima de 12 anos com urticária crônica espontânea refratária ao tratamento com anti-histamínicos H1.
O omalizumabe está contraindicado em pacientes com hipersensibilidade à substância ativa ou a qualquer outro componente do produto. Na apresentação em seringa preenchida, o produto contém látex natural e pode causar reações alérgicas em pacientes com alergia ao látex14.
Esquemas posológicos
No tratamento da asma e da RSCcPN, as doses de omalizumabe são calculadas de acordo com o nível de IgE total sérico (UI/mL) e com o peso do paciente (kg). A dose estabelecida é de 0,016 mg/kg por UI/mL de IgE total variando entre um e quatro frascos ampolas de 150 mg (150 a 600 mg) administrados por via SC em intervalos de duas a quatro semanas. A dose é calculada conforme o peso do paciente e o nível de IgE total (prévio ao tratamento), sendo que os níveis de IgE total nos pacientes elegíveis devem estar entre 30-1500 IU/mL e o peso corporal entre 20-150 kg, conforme a tabela apresentada na bula14.
Na UCE, recomenda-se uma dose fixa de dois frascos de 150 mg (dose total = 300 mg) a cada quatro semanas. Entretanto, no último consenso internacional de urticária ficou estabelecido que, na ausência de melhora com a dose inicial de 300 mg, a dose pode ser aumentada para até 600 mg com o intervalo de duas semanas entre as administrações15.
Eventos adversos
De modo geral, o omalizumabe apresenta um bom perfil de segurança como foi demonstrado nos estudos iniciais e de seguimento ao longo de quase vinte anos de uso na prática clínica. As reações adversas mais frequentemente relatadas nos estudos em pacientes adultos com asma foram reação no local da aplicação, infecção respiratória, sinusite, cefaleia e faringite14. O risco do desenvolvimento de anafilaxia ao omalizumabe é baixo, em torno de 0,09%, a maioria (77%) ocorrendo nas primeiras 2 horas após a administração das três primeiras doses16. Estudos clínicos, assim como estudos da vida real na população pediátrica, também mostraram perfil de segurança geral aceitável sem evidências de aumento do risco de anafilaxia, urticária, reações de hipersensibilidade e malignidades17.
Na urticária crônica espontânea, os eventos adversos mais comuns descritos nos estudos pivotais foram reações no local da aplicação, seguido por infecções do trato respiratório superior e cefaleia18. Nos estudos de vida real, foram relatados uma média geral de 4% (1 a 7%) de eventos adversos, enquanto nos ensaios clínicos esses foram relatados em 2,9 a 8%19.
Nos estudos de omalizumabe em RSCcPN, 50,4% dos pacientes apresentaram pelo menos um evento adverso. A maioria dos quais foi de leve a moderada intensidade, sendo os mais comuns a cefaleia, nasofaringite e reação no local da aplicação12.
Excipientes
Os excipientes incluem sacarose, histidina, cloridrato de histidina monoidratado e polissorbato. Cada ampola diluente contém 2 mL de água para injeção, usada para dissolução do pó14.
A Tabela 1 apresenta o uso clínico do omalizumabe de forma sumarizada.
Mepolizumabe
Mecanismos de ação
O mepolizumabe é um anticorpo monoclonal IgG1/k humanizado de origem murina que se liga com alta afinidade à interleucina-5 (IL-5) humana e previne a interação dessa citocina com a subunidade alfa do receptor de IL-5 (IL-5R). A IL-5 é uma importante citocina do tipo 2 que pode ser produzida pela ativação da imunidade adquirida (linfócitos T helper 2- Th2) e também pela via da imunidade inata (células linfoides inatas do tipo 2- ILC2), apresentando um papel fundamental na inflamação eosinofílica. A IL-5 é essencial na maturação de eosinófilos na medula óssea e na sua liberação para o sangue. Em humanos, a IL-5 atua em eosinófilos, participando da sua proliferação, maturação, recrutamento, ativação e sobrevida. A IL-5 parece modular o desenvolvimento e funções de basófilos e mastócitos, aumentando a liberação de mediadores de basófilos por meio da ligação ao IL-5R presente em basófilos20.
A eficácia do mepolizumabe está bem documentada na asma grave eosinofílica, com redução do número de exacerbações graves, controle de sintomas, melhora da qualidade de vida, redução do uso de corticosteroide oral e melhora da função pulmonar. O mepolizumabe reduz significativamente a eosinofilia sanguínea e no escarro21.
Indicações e contraindicações
O mepolizumabe está indicado para o tratamento da asma grave eosinofílica (≥ 6 anos de idade), RSCcPN (≥ 18 anos de idade), granulomatose eosinofílica com poliangeíte- GEPA (≥ 18 anos de idade) e síndrome hipereosinofílica (≥ 12 anos de idade)22.
O mepolizumabe está contraindicado em pacientes com hipersensibilidade conhecida ao medicamento ou a qualquer um de seus excipientes.
Esquemas posológicos
Os esquemas posológicos para as indicações licenciadas no país estão abaixo descritos e são diferenciados de acordo com a indicação e faixa etária:
Asma grave eosinofílica: crianças de 6 a 11 anos- 40 mg, por via SC, a cada 4 semanas; adolescentes e adultos- 100 mg, por via SC, a cada 4 semanas.
Rinossinusite crônica com pólipo nasal: 100 mg, por via SC, a cada 4 semanas.
Granulomatose eosinofílica com poliangeíte: 300 mg, por via SC, a cada 4 semanas.
Síndrome hipereosinofílica: 300 mg, por via SC, a cada 4 semanas.
Eventos adversos
Os estudos pivotais e de extensão no mundo real, com seguimento por três a cinco anos, documentam um bom perfil de segurança para a terapia anti-IL-5. Os eventos adversos mais frequentemente relatados incluem cefaleia, infecções em vias aéreas superiores, reações no local de aplicação e erupções cutâneas23.
Excipientes
Os excipientes incluem sacarose, fosfato de sódio dibásico heptaidratado, ácido cítrico monohidratado, polissorbato 80, edetato dissódico di-hidratado e água para injetáveis22.
A Tabela 2 apresenta o uso clínico do mepoli-zumabe.
Benralizumabe
Mecanismo de ação
O benralizumabe é um anticorpo monoclonal IgG1/k humanizado, afucosilado, de origem murina que se liga à subunidade alfa do IL-5R, impedindo a conformação do receptor e a ligação da IL-5. Como consequência, a IL-5 não pode exercer seus efeitos biológicos nas células alvo. Além desse mecanismo de ação, o benralizumabe interage com o receptor de superfície FcyRIIIα das células natural killer (NK), via sua porção Fc, induzindo a morte de eosinófilos residentes e circulantes por citotoxidade mediada por células dependente de anticorpos (ADCC)21.
Os estudos sobre o benralizumabe na asma demonstraram eficácia na redução das exacerbações graves, controle de sintomas, melhora da qualidade de vida, redução do uso de corticosteroide oral e melhora da função pulmonar. O benralizumabe reduz rápida e significativamente a eosinofilia sanguínea e no escarro24.
Indicações e contraindicações
O benralizumabe está indicado como tratamento complementar em pacientes com asma grave eosinofílica com ≥ 18 anos. Está contraindicado em pacientes com hipersensibilidade conhecida ao benralizumabe ou a qualquer um de seus excipientes25.
Esquemas posológicos
O esquema posológico na asma grave eosinofílica é 30 mg (1 seringa), por via SC, a cada 4 semanas nas três primeiras doses e, posteriormente, 30 mg (1 seringa) a cada 8 semanas25.
Eventos adversos
Os principais eventos adversos descritos são cefaleia, nasofaringite, febre, dor no local da aplicação, reações de hipersensibilidade (anafilaxia, angioedema, urticária), exacerbação da asma e pneumonia26.
Excipientes
Os excipientes incluem histidina, cloridrato de histidina monoidratado, trealose di-hidratada, polissorbato 20 e água para injetáveis25.
O uso clínico do benralizumabe é apresentado de forma sumarizada na Tabela 3.
Dupilumabe
Mecanismo de ação
O dupilumabe é um anticorpo monoclonal IgG4 totalmente humano com afinidade de ligação à cadeia alfa do receptor de IL-4 (IL-4Rα), que é uma cadeia comum ao receptor de IL-4 do tipo I (IL-4α/IL-2Rγ) e ao do tipo II (IL-4α/IL-13Rα1), que são receptores, respectivamente, para IL-4 e IL-13. Desse modo, este anticorpo tem uma ação de dupla inibição em duas citocinas chaves na inflamação do tipo 2, além de ação sinérgica em efeitos biológicos compartilhados pela IL-4 e IL-13, como o switch em linfócitos B para produção de IgE, quimiotaxia de eosinófilos e hiperresponsividade brônquica27.
As ações da IL-4 e IL-13 na pele na dermatite atópica incluem a contrarregulação da expressão de filagrina, loricrina e involucrina em queratinócitos e exacerbação da disfunção da barreira epidérmica28.
Na asma com inflamação tipo 2, a IL-13 tem ações importantes no epitélio brônquico promovendo aumento da produção de muco pelas células caliciformes, espessamento da membrana basal e aumento da contratilidade da musculatura lisa. Além disso, a IL-4 tem ação sobre os linfócitos Th0, estimulando sua diferenciação para Th2, agravando o processo da inflamação alérgica do tipo 227.
Indicações e contraindicações
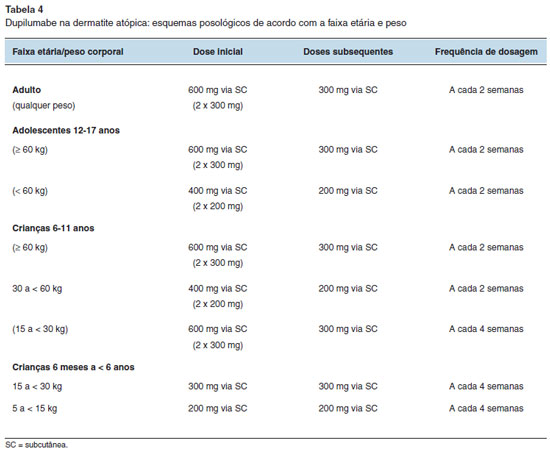
O dupilumabe está indicado na forma grave de dermatite atópica (DA) em crianças de 6 meses a 11 anos e nas formas moderada a grave em adolescentes e adultos, cuja doença não seja adequadamente controlada com o tratamento tópico otimizado. A terapia tópica da DA pode ser mantida durante o uso do dupilumabe.
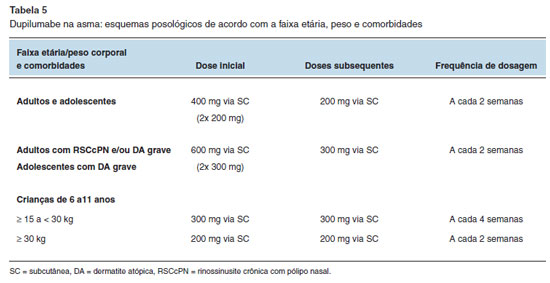
O dupilumabe está indicado também no tratamento da asma grave com inflamação tipo 2 (≥ 6 anos), na rinossinusite crônica com pólipo nasal (≥ 18 anos) e na esofagite eosinofílica (≥ 12 anos e ≥ 40 kg)29.
A única contraindicação do dupilumabe, descrita em bula, refere-se a pacientes com hipersensibilidade conhecida ao medicamento ou a qualquer um de seus componentes.
Esquemas posológicos
Os esquemas posológicos na DA são variáveis de acordo com a indicação clínica, faixa etária e peso corporal, podendo incluir doses iniciais maiores. Nas Tabelas 4 e 5 estão descritos os esquemas posológicos para o uso em pacientes com DA e asma, respectivamente29.
Na RSCcPN, o esquema recomendado é de 300 mg, por via SC, a cada 2 semanas e na esofagite eosinofílica (EoE) 300 mg, por via SC, semanalmente29.
Excipientes
Os excipientes incluem histidina, cloridrato de arginina, acetato de sódio, sacarose, polissorbato 80 e água para injetáveis29.
Eventos adversos
O dupilumabe apresenta bom perfil de segurança documentado nos estudos pivotais e confirmado em estudos de extensão com duração de três anos, na dermatite atópica e na asma30,31.
Os principais eventos adversos descritos com o uso de dupilumabe na DA são infecções de vias aéreas superiores, conjuntivite, cefaleia e reação no local de aplicação. Nos estudos com dupilumabe para tratamento da asma e RSCcPN são observados o mesmo perfil de eventos adversos, com exceção da conjuntivite, que parece ser um evento adverso específico em pacientes com DA. Essa conjuntivite tende a ser leve a moderada, acomete cerca de 10-23% dos tratados e tem patogênese pouco compreendida. Várias teorias foram postuladas, dentre elas inflamação ocular mediada por IL-17; eosinofilia após administração de dupilumabe; aumento da atividade do OX40L nos olhos; e inibição sistêmica de IL13, causando redução da produção de mucina de forma indireta32.
A hipereosinofilia sanguínea (> 1.500 células/mm3) é um evento adverso laboratorial observado em 4% a 15% dos pacientes em tratamento para asma grave com inflamação tipo 2. Frequentemente é assintomática e não indica a necessidade de suspensão do tratamento, tendendo a se resolver após 6 meses de tratamento, na maioria dos pacientes. Contudo, foram descritos 5 casos de granulomatose eosinofílica com poliangeíte (GEPA)6.
Alterações dermatológicas não associadas à atopia têm sido gradativamente descritas após comercialização do dupilumabe. Uma revisão sistemática recente demonstrou que até 45% dos pacientes podem desenvolver alguma lesão não explicada pela doença de base, como dermatite seborreica, rash rosácea-símile, flushing facial, eritema facial e no pescoço33.
Tezepelumabe
Mecanismo de ação
Tezepelumabe é um anticorpo monoclonal totalmente humano (IgG2λ) que se liga especificamente à linfopoeitina do estroma tímico (TSLP) inibindo a sua ligação ao complexo receptor de TSLP em diferentes células-alvo. A TSLP é uma citocina da imunidade inata pertencente ao grupo das alarminas, que atua como ativador de vias celulares e moleculares que promovem inflamação das vias aéreas. É secretada pelas células epiteliais das vias aéreas após dano tecidual induzido por vários agentes nocivos incluindo alérgenos, vírus, bactérias e poluentes. A TSLP interfere nas funções de várias células imunoinflamatórias e estruturais que coexpressam o receptor de TSLP. Juntamente com outras alarminas, como interleucina 25 (IL-25) e interleucina 33 (IL-33), a TSLP prolonga a sobrevivência de células linfoides inatas do tipo 2 (ILC2) e estimula essas células a produzirem grandes quantidades de IL-5, interleucina 9 (IL-9) e interleucina 13 (IL-13)34.
Na asma alérgica, por meio da ativação de células dendríticas, a TSLP ajuda a promover a diferenciação de linfócitos Thelper indiferenciadas (Th0) para a linhagem Th2, que secretam IL-4, IL-5 e IL-13 e têm como alvo células B, eosinófilos, mastócitos e células musculares lisas das vias aéreas. Na asma eosinofílica não alérgica, a TSLP estimula as células linfoides inatas do tipo 2 a secretar IL-5 e IL-13. Na asma neutrofílica, a TSLP induz células dendríticas a estimular o desenvolvimento de linfócitos Th17, que ativam neutrófilos. A TSLP também interage com mastócitos e células estruturais das vias aéreas, incluindo células epiteliais, fibroblastos e células musculares lisas35.
O bloqueio da TSLP com tezepelumabe reduz um espectro amplo de biomarcadores e citocinas associados com inflamação, como eosinófilos no sangue, IgE, FeNO, IL-5 e IL-13 e promove redução da frequência de exacerbações graves, de idas a emergências e hospitalizações por asma, melhora do VEF1 pré-broncodilatador, assim como controle de sintomas e melhora da qualidade de vida dos pacientes com asma36,37.
Indicações e contraindicações
Tezepelumabe é indicado como terapia adicional ao tratamento de manutenção de pacientes com asma grave com 12 anos de idade ou mais, independentemente do fenótipo inflamatório da doença (T2 ou não T2)38. Está contraindicado em pacientes com hipersensibilidade conhecida ao tezepelumabe ou a qualquer um de seus excipientes39.
Esquemas posológicos
O esquema posológico recomendado para adultos e adolescentes (12 anos ou mais) é de 210 mg, por via subcutânea, a cada 4 semanas. Não é necessário ajuste de doses para indivíduos com mais de 65 anos de idade e nem com disfunção hepática ou renal39.
Eventos adversos
Nos estudos clínicos pivotais em pacientes com asma grave, as reações adversas mais comumente relatadas foram artralgia, faringite, erupção cutânea e reações no local da aplicação37,40. O perfil de segurança durante o estudo de extensão de longo prazo foi, no geral, semelhante ao perfil de segurança já identificado. Reações de hipersensibilidade podem ocorrer após a administração de tezepelumabe, porém até o momento não foram relatados casos de anafilaxia39.
Excipientes
Os excipientes incluem L-prolina, ácido acético glacial, polissorbato 80, hidróxido de sódio, água para injeção39.
O uso clínico do tezepelumabe encontra-se resumido na Tabela 6.
Critérios de avaliação da eficácia
Asma
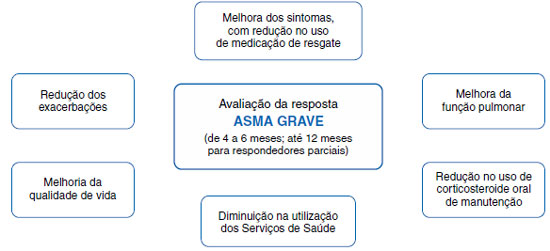
Os principais desfechos clínicos, que devem ser os objetivos a alcançar no tratamento da asma grave com imunobiológicos, são a redução de exacerbações graves (as que requerem uso de corticosteroide oral ou atendimento de emergência ou hospitalização), a redução ou suspensão do uso contínuo de corticosteroide sistêmico, a melhora da função pulmonar, a melhora do controle da asma com redução de sintomas e do uso de medicação de resgate, além de melhora da qualidade de vida dos pacientes, com a consequente redução de utilização de serviços de saúde (Figura 1)41.
Não existem critérios estabelecidos mundialmente para a avaliação da resposta aos imunobiológicos na asma. Alguns critérios, em geral definidos por metodologias diferentes, envolvendo consensos locais ou regionais, foram sugeridos por diferentes grupos e sociedades nacionais e internacionais, e ainda carecem de melhor validação em estudos de mundo real.
A Tabela 7 descreve os critérios propostos pela Global Asthma Association, publicados recentemente. De acordo com esses critérios, é considerada uma boa resposta à terapia biológica quando o paciente preenche três ou mais critérios de eficácia42.

Os critérios estabelecidos no Protocolo Clínico e Diretrizes Terapêuticas da Asma (Sistema Único de Saúde) e na Saúde Suplementar (ANS) são similares, mas não incluem os potenciais eventos adversos. Os critérios propostos por diretrizes nacionais incluem apenas os itens 1 e 2 descritos na Tabela 7, avaliados após um ano de terapia biológica43.
Urticária crônica espontânea
As principais ferramentas para a avaliação do controle e atividade da UCE são o Teste de Controle da Urticária (UCT, variação entre 0-16, onde o paciente apresenta-se totalmente controlado quando UCT = 16), e o Escore de Atividade da Urticária por 7 dias (UAS7, variação entre 0-42, onde o paciente apresenta-se sem atividade da urticária quando UAS7 = 0). A avaliação da resposta ao omalizumabe deve ser realizada com 3 e 6 meses de tratamento. Cerca de 61% dos pacientes com UCE respondem rapidamente à terapia ainda no 1º mês da aplicação (respondedores rápidos), e uma parcela menor (cerca de 27%) responde mais lentamente, entre o 1º e 6º mês de tratamento (respondedores tardios)15.
Pacientes com controle inadequado (UCT < 12 e/ou UAS7 > 7) com o esquema posológico padrão de 300 mg de omalizumabe a cada 4 semanas devem ter seu esquema posológico modificado. Existem duas possibilidades: redução do intervalo entre as aplicações para 2 semanas; ou aumento da dose, que pode ser escalonado, inicialmente para 450 mg e, se necessário, posteriormente para 600 mg ou aumento direto para 600 mg. Dessa forma, os regimes de tratamento são flexíveis e ajustados com base na avaliação de atividade da doença e controle dos sintomas, propiciando aos pacientes que não respondem ao esquema padrão uma melhor resposta clínica ao omalizumabe, com bom perfil de segurança44,45.
Nos pacientes com boa resposta clínica ao omalizumabe e doença controlada não há biomarcadores que indiquem a remissão da urticária. Assim sendo, o tempo total de duração da terapia com o omalizumabe na UCE não está estabelecido, devendo-se interromper o biológico após controle completo dos sintomas para avaliar a possibilidade de remissão da doença. Portanto, após o controle total da UCE (UCT = 16 e UAS7 = 0) por período igual ou superior a 6 meses, a decisão sobre a descontinuação do tratamento deve ser individualizada e seguir critérios médicos15.
Dermatite atópica
Várias ferramentas estão disponíveis para a avaliação da gravidade da dermatite atópica e da resposta ao tratamento. Os instrumentos utilizados como desfechos primários nos estudos pivotais com o dupilumabe foram o Índice de Gravidade e Área do Eczema com melhora de 75% (EASI-75) e Avaliação Global do Investigador (IGA). Os desfechos secundários incluíram os seguintes parâmetros: EASI-50, EASI-90, Escore de Gravidade da Dermatite Atópica (SCORAD), Medida de Eczema Orientada pelo Paciente (POEM), Escala de Classificação Numérica do Prurido (NRS), Impacto Familiar da Dermatite (IFD), Escala de Depressão e Ansiedade Hospitalar (HADS), Índice de Qualidade de Vida em Dermatologia (DLQI) e Índice de Qualidade de Vida em Dermatologia em Crianças (CDLQI)46-51.
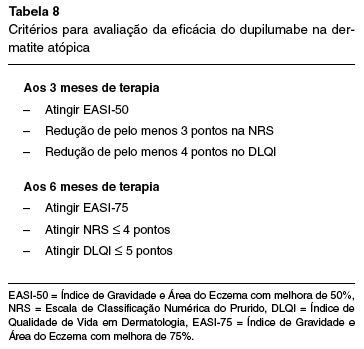
Embora não exista um consenso mundialmente estabelecido sobre os parâmetros para a avaliação da eficácia do dupilumabe na dermatite atópica, existem recomendações a respeito. A diretriz de Portugal para a terapia sistêmica da dermatite atópica recomenda a avaliação após 3 e 6 meses de tratamento, com a utilização do EASI-50 e EASI-75, NRS do prurido e DLQI, conforme descrito na Tabela 852.
Rinossinusite com pólipo nasal
O grupo de experts em rinossinusite crônica com polipose nasal não controlada e biológicos do European Forum for Research and Education in Allergy and Airway Diseases (EUFOREA)53 recomenda que a avaliação da resposta à terapia biológica na RSC com PN deve ser realizada após 6 e 12 meses de tratamento, utilizando as seguintes ferramentas: avaliação do olfato por teste validado, Escore de Pólipo Nasal (NPS), Escore de Congestão Nasal (NCS), Teste de Desfecho Nasossinusal 22 (SNOT-22) e escala analógica visual (EVA), conforme descrito na Figura 2. Além desses instrumentos, deve também ser avaliada a necessidade de uso de corticosteroide oral e abordagem cirúrgica ao longo do período de tratamento.
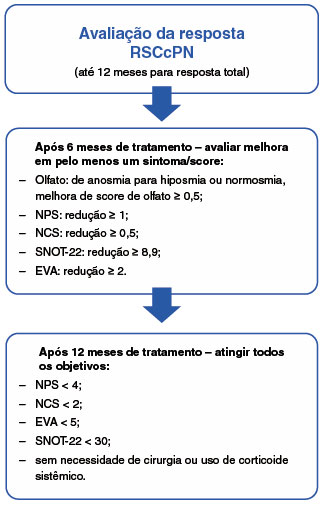
Figura 2
Avaliação da resposta à terapia biológica na RSCcPN
Olfato = avaliado por teste validado (CONNECTICUT ou UPSIT), NPS = escore de pólipo nasal (Lund-Kennedy ou Lund-Mackay), NCS = escore de congestão nasal, RSCcPN = rinossinusite crônica com pólipo nasal, SNOT-22 (Sino-Nasal Outcome Test) = teste de desfecho nasossinusal 22, EVA = escala visual analógica.
Modificado de Bachert C, et al.53
Esofagite eosinofílica
Não existe uma definição padronizada de resposta às diversas modalidades de terapia medicamentosa na esofagite eosinofílica (EoE)54. Contudo, nos estudos clínicos do dupilumabe conduzidos em adolescentes e adultos com EoE foram utilizados como desfechos primários os seguintes parâmetros: redução do pico da contagem de eosinófilos no exame histopatológico da mucosa esofágica e redução dos sintomas de disfagia avaliados pelo Dysphagia Symptoms Questionnaire (DSQ)55.
Com relação ao ponto de corte para a resposta histológica, nos estudos pivotais do dupilumabe foi utilizado o valor de 6 eosinófilos/HPF (campo de grande aumento). Entretanto, alguns autores consideram como resposta satisfatória para as demais modalidades de terapia o valor de 15 eosinófilos/HPF56.
Nos estudos com o dupilumabe não foi estabelecido um ponto de corte para a redução do escore do DSQ, tendo sido realizada uma análise comparativa da média de redução absoluta do grupo em tratamento versus o grupo placebo2. O DSQ avalia um período de 14 dias e os valores são variáveis entre 0 e 84, com os valores mais altos indicando maior gravidade57. Na prática clínica, é necessário estabelecer um ponto de corte de diferença minimamente significativa. Assim sendo, é razoável utilizar ponto de corte proposto para outras terapias, que consideram uma melhora significativa a redução de > 30% no escore do DSQ58.
A avaliação da resposta clínica ao dupilumabe deve ser realizada com 3 e 6 meses de tratamento (prazo em que biológico apresenta melhor resposta)55. Nos pacientes com boa resposta clínica, a avaliação da resposta histológica pode ser realizada somente aos 6 meses; enquanto naqueles com resposta clínica ausente ou insuficiente aos 3 meses, é recomendável a avaliação histológica também nesse prazo54.
Em casos de resposta discordante entre a remissão histológica e a resposta clínica, outros parâmetros podem ser utilizados como a avaliação da atividade inflamatória por meio da endoscopia. O principal instrumento utilizado é o Endoscopic Reference Scoring System (EREFS), que avalia edema, anéis, exsudatos, estrias e estreitamento, variando de 0 a 18, com os escores mais elevados indicando maior gravidade. Foi proposto também como desfecho de melhora clínica na avaliação endoscópica a redução de alterações inflamatórias macroscópicas combinada a diâmetro esofágico > 15 mm54,56.
Síndromes hipereosinofílicas
As síndromes hipereosinofílicas (SHE) são um grupo de distúrbios raros caracterizados por contagem de eosinófilos elevados no sangue (> 1.500 células/mm3) e/ou em tecidos. A apresentação clínica é altamente variável, envolvendo manifestações dermatológicas, pulmonares, gastrintestinais e cardiovasculares59. O tratamento padrão inclui corticosteroides, medicamentos citotóxicos e terapia imunossupressora. O imatinibe está indicado para os pacientes com variantes sensíveis a esse fármaco. Recentemente, o mepolizumabe foi aprovado para o tratamento de pacientes com SHE, entretanto ainda não foram estabelecidos critérios de resposta ao tratamento com biológicos60.
Contudo, podemos aplicar na prática clínica como critério de boa resposta os principais desfechos primários utilizados nos estudos clínicos, que foram os seguintes: (1) redução de crises e (2) redução da dose do corticosteroide oral ou da terapia imunossupressora/citotóxica de manutenção. Certamente, é importante também monitorar a eosinofilia sanguínea. No estudo clínico pivotal, foi observado que a redução máxima da contagem de eosinófilos no sangue é atingida com 8 semanas de terapia com o mepolizumabe61,62.
Monitoramento, manejo e notificação de eventos adversos
Monitoramento de eventos adversos
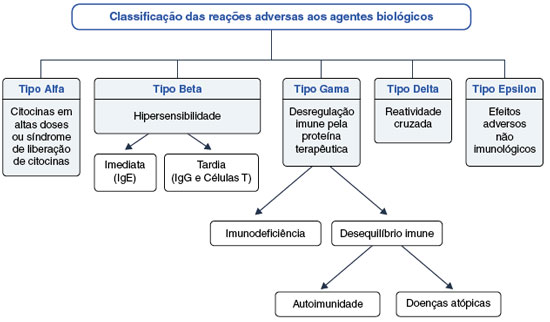
Evento adverso (EA) com um medicamento pode ser definido como qualquer alteração desfavorável à saúde do paciente após sua administração. Eles podem ser leves, moderados ou graves, e podem ocorrer imediatamente após a administração ou após um período prolongado63. Os EAs induzidos pelos xenobióticos (fármacos tradicionais) são principalmente relacionados aos efeitos farmacológicos, enquanto os efeitos adversos dos agentes imunobiológicos estão frequentemente relacionados à molécula alvo e consequências biológicas de suas ações26. Considerando essas diferenças, Pichler64 propôs uma classificação especial para as reações adversas aos imunobiológicos, que estão sumarizadas na Figura 3.
Embora os estudos pivotais e de extensão demonstrem a segurança dos anticorpos monoclonais utilizados na terapia das doenças alérgicas e não se exija um monitoramento laboratorial específico, há uma permanente preocupação quanto ao desenvolvimento de efeitos adversos ainda não descritos, haja vista o potencial de antigenicidade das moléculas, a interferência com vias de resposta inflamatória inata, resposta imunológica adaptativa e com os eosinófilos5.
Em relação ao risco de parasitoses, recomenda-se o rastreamento pré-tratamento e monitoramento durante o uso em pacientes de alto risco. Importante ressaltar que essa recomendação é baseada em um risco teórico6.
Considerações mais detalhadas com relação às infecções/parasitoses estão apresentadas em tópico desenvolvido na sequência deste artigo.
Quanto ao risco de malignidade, estudos epidemiológicos questionaram a existência de associação de câncer com alguns imunobiológicos, como o omalizumabe. Até o presente, não existem quaisquer evidências de relação causal entre os biológicos utilizados na terapia de doenças alérgicas e aumento do risco de doenças malignas. A triagem para câncer, portanto, está indicada de acordo com critérios de idade, sexo e fatores de risco específicos utilizados na população em geral6-8,11.
Em resumo, apesar de não haver uma recomendação de monitoramento laboratorial para uso de imunobiológicos em doenças alérgicas, o imunoalergista prescritor deve constantemente monitorar o desenvolvimento dos eventos adversos descritos especificadamente para cada imunobiológico, bem como periodicamente atualizar-se quanto a novos eventos adversos que possam ocorrer com a ampliação da utilização por pacientes em situações de mundo real.
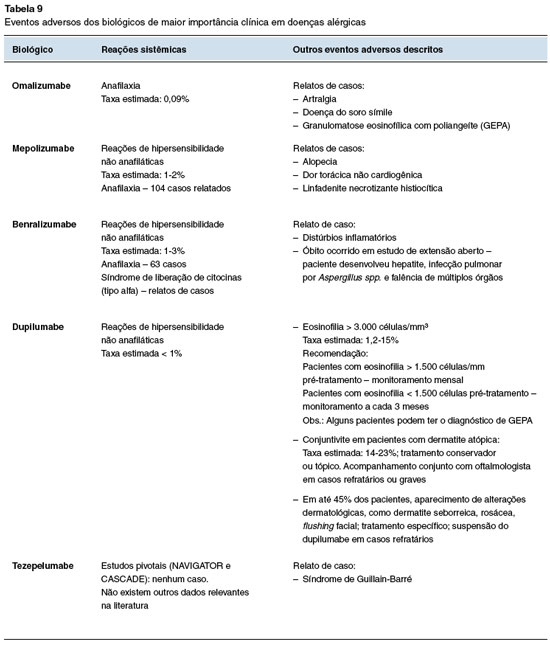
A Tabela 9 compila os eventos adversos de maior relevância clínica descritos até o momento, incluindo revisões sistemáticas, estudos de mundo real ou relatos de casos6,23.
Manejo de eventos adversos
A maioria dos eventos adversos (EA) descritos são leves, sem necessidade de monitoramento laboratorial periódico ou suspensão da terapia biológica. As reações locais na região de aplicação são as mais comuns, e em geral não requerem pré-medicação ou tratamento específico26.
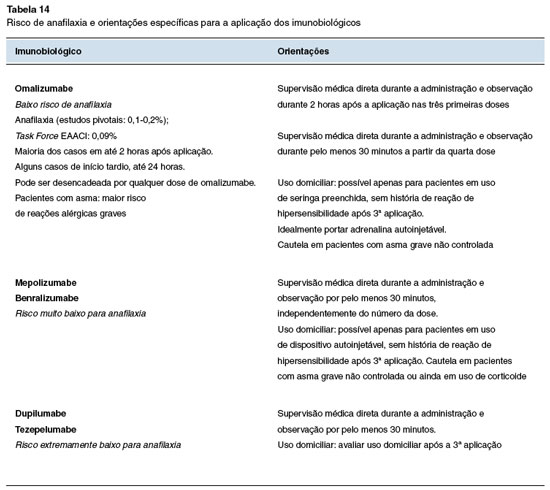
O omalizumabe possui risco de anafilaxia estimado em 0,09% e, portanto, os médicos prescritores devem conversar com os pacientes/responsáveis sobre esse risco, previamente ao tratamento. O manejo em caso de anafilaxia deve seguir as diretrizes estabelecidas nacionalmente e internacionalmente81.
Outros imunobiológicos possuem risco de reações de hipersensibilidade não anafilática estimado em 1-2%. Em casos leves, podem ser conduzidos conservadoramente ou com sintomáticos, como anti-histamínicos e/ou antitérmicos3.
A terapia com dupilumabe em pacientes com dermatite atópica é associada à doença de superfície ocular (conjuntivite, blefarite e ceratite), que embora frequente (14 a 23%), tende a ser leve e se resolver com conduta conservadora. Em alguns casos mais graves ou refratários, deve-se fazer uso de terapia tópica, recomendando-se acompanhamento conjunto com oftalmologista. Raramente, recomenda-se a suspensão do imunobiológico66. Lesões cutâneas não alérgicas (especialmente na face e pescoço) têm sido descritas após-comercialização, porém a maioria é leve e responde ao tratamento tópico. Uma revisão sistemática estimou que 11% desses pacientes suspenderam a medicação por esse evento adverso33.
Outra preocupação associada ao dupilumabe é a presença de eosinofilia após início do tratamento (até 15% dos pacientes). Na maioria das vezes é assintomática, tendendo ao pico entre 4-16 semanas de tratamento, com posterior retorno à linha de base do paciente. Há recomendação de monitoramento a depender do grau (vide Tabela 9), e a suspensão é recomendada apenas em casos sintomáticos ou com diagnóstico alternativo (por exemplo, GEPA)67,68.
Com relação ao benralizumabe é estimado que até 3% dos pacientes possam apresentar rash urticariforme, que pode ser manejado com anti-histamínicos69.
Notificação de eventos adversos
Notificar um EA é importante, pois permite que os órgãos responsáveis monitorem a segurança desses produtos e identifiquem os potenciais riscos. Em geral, as instituições de saúde possuem procedimentos operacionais em farmacovigilância, devendo o médico comunicar ao farmacêutico responsável e registrar em prontuário médico o EA. No Brasil, além dos protocolos internos de cada instituição, a notificação de EA com imunobiológicos deve ser realizada pelo sistema VigiMed (disponível em: https://www.gov.br/anvisa/pt-br/assuntos/fiscalizacao-e-monitoramento/notificacoes/vigimed) e o fabricante do biológico também deve ser comunicado.
Qualquer pessoa pode e deve notificar um EA, mas é de responsabilidade médica garantir a notificação quando se tenha conhecimento. Para notificar um EA pelo VigiMed, é necessário preencher um formulário online, que solicita informações sobre o paciente, o imunobiológico, o EA e as circunstâncias da administração do produto.
Imunobiológicos e imunizações
Até o presente, não existem recomendações específicas no Brasil para os pacientes em uso dos imunobiológicos para doenças alérgicas, devendo-se atualizar o calendário de acordo com o risco individual, no mínimo um mês antes do início do tratamento com um imunobiológico. Como são medicamentos relativamente novos, ainda não são conhecidos todos os potenciais riscos, efeitos adversos e interações com as vacinas do Programa Nacional de Imunização (PNI)70.
Devido ao baixo risco teórico, os imunobiológicos atualmente aprovados para doenças alérgicas podem ser utilizados com vacinas inativadas (vacinas de mRNA, conjugadas, toxoides e de vetor viral não patogênico) e não precisam ser suspensos, desde que seja evitada a aplicação das vacinas no mesmo dia do imunobiológico (preferivelmente se recomenda intervalos maiores de 7 dias). As vacinas de aplicações sazonais ou periódicas (gripe ou dTpa) devem ser aplicadas sem restrições71.
É importante salientar que embora as vacinas de mRNA e de vetor viral funcionem de maneira ligeiramente diferente que as inativadas, nenhuma delas é vacina de vírus vivo e, portanto, podem ser administradas com segurança nos pacientes que recebem tratamento biológico para alergia. Assim, as vacinas atualmente disponíveis para COVID-19 são indicadas para uso concomitante com os imunobiológicos aqui descritos, sejam as de vírus inativado (Sinovac/Butantan); de mRNA (Pfizer-BioNTech; e Moderna); ou de vetor viral (Johnson & Johnson, Oxford-Astra-Zeneca e Verity Pharmaceuticals-Serum Institute of India)72.
Para vacinas vivas atenuadas (Tabela 10), no entanto, é necessário cautela. Embora não existam dados que demonstrem maior risco de vacinas atenuadas nesse contexto, essa recomendação baseia-se nos estudos pivotais do dupilumabe (SOLO1 e SOLO2) e do tezepelumabe (CASCADE E NAVIGATOR), que não incluíram pacientes que haviam recebido vacinas atenuadas nas 4 semanas anteriores ao início dos estudos. Quando o benefício de uma vacina atenuada superar os riscos, o tratamento biológico pode ser interrompido com base na meia-vida do medicamento (Tabela 11), sendo retomado assim que a viremia da vacina for eliminada (ex: a duração da viremia para o vírus da varicela é de 14 dias)71-74.

O mepolizumabe e benralizumabe foram associados a potencial risco de reativação de herpes zoster (seção "Imunobiológicos e infecções/parasitoses"). Assim sendo, é recomendável que os pacientes com indicação para a vacina herpes zoster (> 50 anos e/ou com condição de risco) sejam imunizados 4 semanas antes do início do tratamento6,75.
Imunobiológicos e infecções/Parasitoses
As principais vias de resposta inflamatória a microrganismos e parasitas são subdivididas em inflamação tipo 1, tipo 2 e tipo 3, que são direcionadas, respectivamente, aos vírus e bactérias intracelulares, aos parasitas e às bactérias extracelulares e fungos. Os anticorpos monoclonais utilizados no tratamento das doenças alérgicas interferem, em sua maioria, com a via de inflamação Tipo 2, via imunidade inata e/ou adaptativa, que é a via envolvida na resposta a alérgenos e inflamação eosinofílica, preservando a resposta imunológica contra a maioria dos microrganismos. Contudo, os mastócitos e eosinófilos têm uma participação importante na imunidade inata e o tezepelumabe interfere com o topo da cascata inflamatória bloqueando a TSLP- uma importante alarmina do sistema imune inato em resposta a diversas agressões ao epitélio, incluindo alérgenos, poluentes, vírus e bactérias.
Os ensaios clínicos, estudos de extensão e estudos de mundo real não têm, de modo geral, apontado risco aumentado de infecções e parasitoses. Apesar disso, existem recomendações específicas com relação a infecções e parasitoses para determinados biológicos6.
Omalizumabe
A IgE pode estar envolvida na resposta imunológica a helmintíases. Conforme comentado (ver seção "Manejo de eventos adversos"), está indicado durante a terapia com omalizumabe o monitoramento e tratamento específico de pacientes com diagnóstico de helmintíase. Entretanto, um estudo brasileiro demonstrou a segurança do omalizumabe em pacientes de alto risco para infecções helmínticas76.
Mepolizumabe
Foi observado em dois estudos de extensão com mepolizumabe na asma um possível risco de reativação por herpes zoster. Assim sendo, é recomendável que os pacientes elegíveis para a vacina herpes zoster sejam imunizados para esse agente pelo menos 4 semanas antes de iniciar a terapia com o mepolizumabe (Tabela 11)6.
Os eosinófilos participam da resposta imunológica às helmintíases. Pacientes com helmintíases pré-existentes foram excluídos dos ensaios clínicos de desenvolvimento do mepolizumabe. Pacientes residentes em áreas endêmicas para helmintíase devem ser triados pré-tratamento e tratados, caso haja o diagnóstico antes do início da terapia com mepolizumabe. Caso os pacientes tenham o diagnóstico de helmintíase durante o tratamento e não respondam ao tratamento anti-helmíntico, deve-se considerar a interrupção temporária do seu uso6.
Benralizumabe
Existem relatos de herpes zoster nos estudos com benralizumabe, mas não existem recomendações específicas (Tabela 11). Com relação às parasitoses, com base no risco teórico, é recomendável o triagem pré-tratamento e a vigilância durante a terapia para os pacientes residentes em áreas endêmicas ou viajantes para essas áreas6,25.
Dupilumabe
Não existe evidência de aumento da incidência da taxa de infecções e parasitoses nos ensaios clínicos. Nos estudos em dermatite atópica, foi observado que aproximadamente 0,4 a 1% dos pacientes desenvolveu herpes zoster e 0,4 a 2%, eczema herpeticum. Contudo, essas taxas não foram superiores às observadas no grupo placebo, e não existem recomendações específicas em bula29.
Tezepelumabe
Nos ensaios clínicos do tezepelumabe na asma não existem relatos de aumento do risco de infecções. O risco de parasitose é desconhecido e, considerando o risco teórico, a bula recomenda o monitoramento de helmintíases em pacientes em tratamento com esse imunobiológico39.
A TSLP pode estar envolvida na resposta imunológica a helmintíases. Antes de iniciar a terapia com tezepelumabe é recomendável a investigação e tratamento de helmintíases pré-existentes. Caso seja diagnosticada parasitose durante a terapia e o paciente não responder ao anti-helmíntico, o tratamento com tezepelumabe deve ser descontinuado até a resolução da infestação.
Aplicação do biológico na vigência de infecções
Não há recomendações universalmente estabelecidas com relação à aplicação de biológicos para doenças alérgicas em pacientes com quadros infecciosos em curso ou recentes. Entretanto, considerando que nos estudos clínicos as doses não foram aplicadas em vigência de infecções virais e/ou bacterianas, o recomendável é postergar a aplicação da dose em 7 a 14 dias, ou mesmo pular uma aplicação, conforme o quadro clínico do paciente e gravidade da infecção.
Essas recomendações foram válidas também para a pandemia de COVID-19. Durante picos epidêmicos, a terapia biológica deve ser mantida em pacientes sem suspeita clínica e sem contágio domiciliar, pois os benefícios do controle da doença alérgica grave superam os riscos da infecção. Além disso, não existem dados na literatura que indiquem maior gravidade da COVID-19 em pacientes com doença alérgica controlada em vigência de terapia biológica. No caso de exposição recente ao SARS-CoV-2, o paciente deve ser investigado e, confirmada a infecção, a aplicação deve ser postergada23,70.
Uso em populações especiais
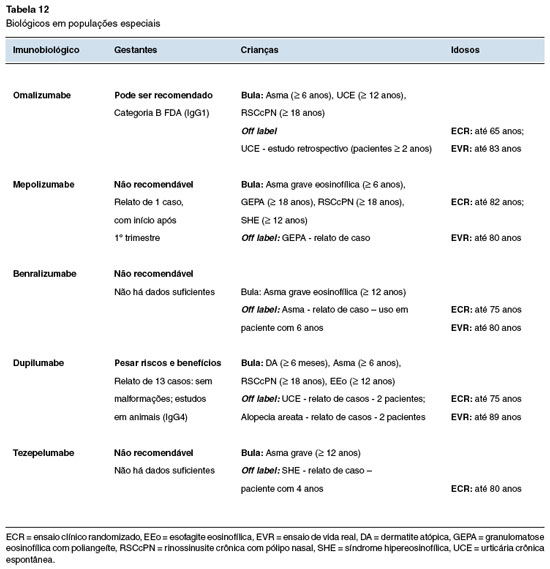
Os ensaios clínicos específicos em lactentes, idosos, nefropatas, hepatopatas ou gestantes são escassos. Quando disponíveis, tendem a ser agrupados com dados de outros pacientes. Os dados disponíveis na literatura são limitados e podem ser de difícil interpretação. Portanto, a recomendação do uso de imunobiológicos nessas populações deve ser feita com cautela, tendo em mente possíveis riscos e benefícios não adequadamente mensurados.
Antes de indicar um imunobiológico em mulheres de idade fértil, é importante ser abordado com a paciente o desejo de gestação e contracepção. Para gestantes, é preciso frisar que os monoclonais são anticorpos IgG e atravessam a barreira placentária (na ordem de maior permeabilidade: IgG1 > IgG4 > IgG3 > IgG2). A excreção no leite humano em geral ocorre em menor fração (1:10.000 a 1:100.000). É importante frisar que mesmo para medicações consideradas seguras na gestação, há falta de informações sobre os efeitos em longo prazo no sistema imunológico em desenvolvimento77.
Um cuidado relevante na indicação em crianças e adolescentes é a forma de aplicação, pois a maioria dos medicamentos é parenteral. Em geral, nefropatas e hepatopatas toleram bem imunobiológicos, pois esses fármacos têm depuração pelo sistema reticuloendotelial. No entanto, esses pacientes podem apresentar outras condições associadas e o uso deve ser monitorado com relação à piora da função renal e/ou hepática78. Na Tabela 12 estão compiladas as principais informações disponíveis sobre o uso em populações especiais6,11,21,23,32,37,40,79,80. Para gestantes, atualmente, o único biológico liberado é o omalizumabe (categoria B)77.
Em resumo, o uso de imunobiológicos em populações especiais deve ser feito com cautela, levando em consideração os riscos e benefícios envolvidos. Especificamente para gestantes, há evidências de que a asma grave não controlada aumenta os riscos de pré-eclâmpsia, prematuridade, diabetes gestacional, além do uso de corticosteroide sistêmico e seus riscos específicos. Para a UCE, não há dados sobre o risco da doença não controlada em gestantes, mas o omalizumabe parece ser eficaz e seguro. Para a RSCcPN, é razoável que se indique alternativas terapêuticas até o término da gestação79,80.
Assim, é recomendável que a decisão de uso nessas populações seja compartilhada com o paciente, discutindo as limitações dos dados e alertando para os riscos teóricos. Caso indicado, deve-se monitorizar as comorbidades e eventos adversos, sendo altamente desejável a publicação desses casos para compartilhamento de experiências.
Cuidados gerais na aplicação e orientações sobre uso domiciliar, armazenamento e transporte
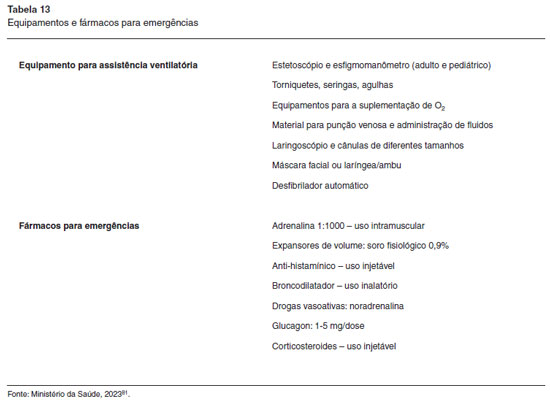
A aplicação de biológicos para doenças alérgicas deve ser realizada em unidade de saúde com infraestrutura (equipamentos e medicamentos) e equipe de saúde capacitada para o manejo de potenciais reações adversas sistêmicas, incluindo procedimentos de entubação orotraqueal e reanimação cardiopulmonar, para garantir a segurança do paciente (Tabela 13). Além disso, existem aspectos que envolvem o transporte e armazenamento necessários para a conservação adequada dos biológicos, sem comprometimento de sua eficácia. Assim sendo, Centros de Infusão de Biológicos são os locais ideais para a aplicação, preferencialmente em unidades de hospital-dia. Os biológicos para doenças alérgicas também podem ser aplicados em clínicas de Alergia e Imunologia que possuam porte para um consultório tipo III, conforme orientado pela resolução CFM 2153, disponível em: http://www.sbai.org.br/imageBank/resolucao-cfm-2153-consultorio-medico.pdf.
As unidades de aplicação devem estabelecer fluxos de atendimento, rotinas de monitoramento e protocolos de segurança que devem ser revisados, no mínimo, semestralmente. O risco de anafilaxia e as orientações específicas quanto à supervisão médica estão sumarizados na Tabela 14.
Com a experiência adquirida por anos de uso de imunobiológicos na prática clínica, observa-se que a incidência de reações graves durante a aplicação é relativamente baixa (< 1%), especialmente em pacientes que já fazem uso e não possuem histórico de reações de hipersensibilidade66.
Sendo assim, após a pandemia e com o advento das seringas preenchidas, houve espaço para reflexão sobre a possibilidade de realização do uso domiciliar de imunobiológicos subcutâneos em pacientes de baixo risco sem história de reações prévias6,82. Recentemente, a FDA autorizou a aplicação domiciliar de omalizumabe em seringa preenchida em pacientes sem história de anafilaxia (a qualquer tipo de alérgeno), desde que o paciente não tenha histórico de reações de hipersensibilidade após receber três aplicações iniciais em unidade de saúde. É recomendável a prescrição de adrenalina autoinjetável domiciliar- recurso não disponível facilmente no Brasil83.
As evidências que suportam o uso domiciliar de imunobiológicos para doenças alérgicas graves são baseadas em experiências práticas, especialmente do exterior. Não há, no momento, critérios objetivos para a indicação do tratamento domiciliar, devendo o médico avaliar o risco, considerando fatores como possibilidade de anafilaxia, gravidade da doença, cognição e comorbidades do paciente, condições socioeconômicas e geográficas, dentre outros84. A escolha do local de aplicação deve ser compartilhada, discutida exclusivamente no contexto da relação entre o médico assistente e o paciente, sem a interferência de terceiros, como unidades hospitalares ou seguradoras de saúde. Os pacientes devem participar ativamente dessa decisão, após serem expostos os benefícios e riscos. Em geral, os benefícios do uso domiciliar percebidos pelos pacientes incluem flexibilidade e otimização de tempo, menor exposição a agentes infecciosos, possibilidade de viajar por longos períodos, dentre outros84. Os riscos associados à aplicação domiciliar incluem os eventos adversos e outros discutidos anteriormente. Deve-se discutir com os pacientes aspectos associados à forma de aplicação, armazenamento e transporte do medicamento, moradia próxima a estabelecimentos de saúde e plano de ação com procura por atendimento médico imediato, caso ocorra qualquer reação de hipersensibilidade ou reações sistêmicas de outra natureza85,86.
Caso o paciente tenha compreendido e decidido em conjunto com o médico pela aplicação domiciliar, o médico deve assegurar o uso correto da medicação. Isso inclui aspectos de armazenamento, aplicação e descarte. Os biológicos devem ser armazenados em refrigerador entre 2 ºC e 8 ºC e não podem ser congelados. A quase totalidade dos biológicos para doenças alérgicas pode ser mantida fora do refrigerador por até 14 dias, desde que a temperatura ambiente não exceda 30 ºC. A exceção é o benralizumabe, que não deve permanecer fora de refrigeração por mais de 24 horas14,22,25,29,39.
Além disso, é fundamental ensinar ao paciente (e familiares) o reconhecimento dos sinais/sintomas de anafilaxia e prescrever um plano de ação por escrito. Também é sugerido que haja um canal de comunicação disponível para contato médico em caso de reação6,66,85. Vale salientar que, mesmo no caso de reação em domicílio, o médico prescritor deve notificar quaisquer eventos adversos (vide seção "Notificação de eventos adversos" ).
Por falta de jurisprudência atual, é fundamental que os médicos prescritores estejam cientes de que pode haver corresponsabilização no caso de reações domiciliares. Recomenda-se o registro em prontuário de detalhes da discussão prévia à liberação domiciliar, com assinatura de termo de consentimento livre e esclarecido (TCLE) e outras medidas que resguardem o profissional.
O uso domiciliar de imunobiológicos no Brasil possui particularidades próprias, que devem ser amplamente discutidas pelos profissionais prescritores, gestores, pacientes e familiares. A análise criteriosa, com fundamentação científica, poderá possibilitar a elaboração de recomendações formais, incluindo critérios que definam o perfil do paciente apto para a aplicação domiciliar de biológicos; considerando não somente aspectos clínicos, mas também o contexto sociocultural, região geográfica, logística e acesso a serviços de saúde. A Tabela 15 sumariza as sugestões aqui discutidas para uso domiciliar.
Acesso pelo SUS e pela Saúde Suplementar
A incorporação de medicamentos no Sistema Único de Saúde (SUS) e na Agência Nacional de Saúde Suplementar (ANS) possibilita o acesso universal ao tratamento medicamentoso, que é um direito fundamental do cidadão e deve ser garantido.
O desenvolvimento de imunobiológicos para o tratamento de doenças alérgicas graves fez surgir a necessidade de incorporação dessas tecnologias no âmbito do SUS e da ANS. Devido a seu alto custo, as incorporações desses medicamentos se tornaram um desafio para gestores, associações médicas e pacientes. Para assegurar a sustentabilidade do sistema de saúde é crucial promover o uso racional dos imunobiológicos.
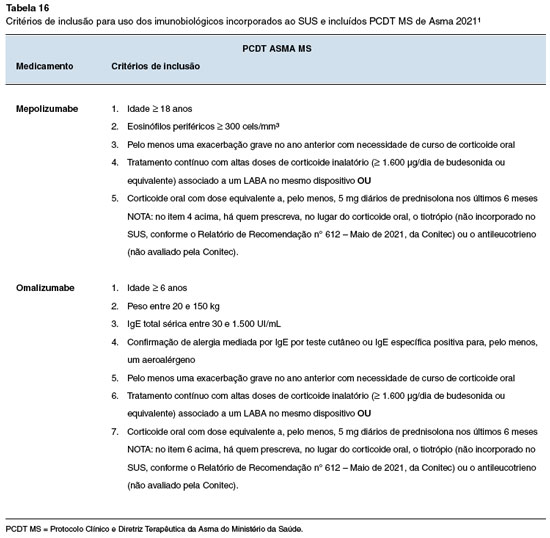
No âmbito do SUS, foram incorporados dois imunobiológicos para asma grave na última revisão do Protocolo Clínico e Diretriz Terapêutica da Asma do Ministério da Saúde (PCDT MS), publicada em 202187. Os imunobiológicos disponibilizados foram o mepolizumabe para asma eosinofílica grave e o omalizumabe para asma alérgica. Os critérios de inclusão no PCDT MS estão listados na Tabela 16.
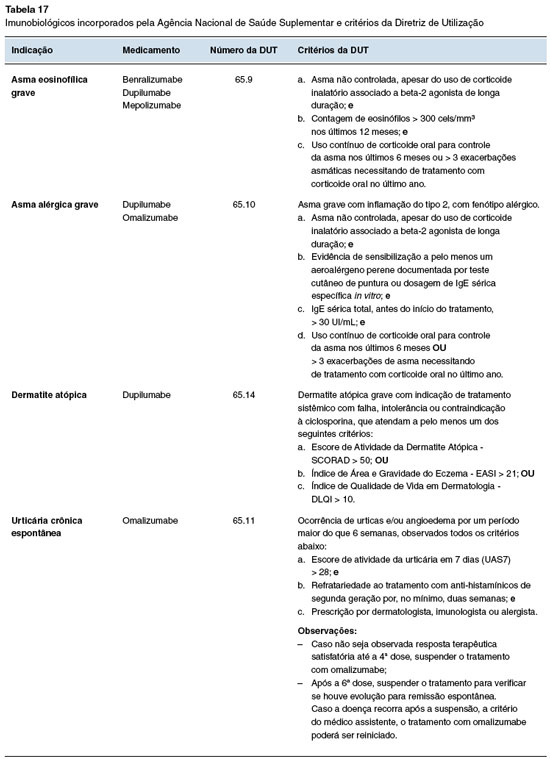
Na saúde suplementar, a ANS fez avanços significativos e incorporou imunobiológicos para asma, dermatite atópica e urticária crônica espontânea, com a criação de Diretrizes de Utilização (DUT) vinculada ao procedimento "Terapia Imunobiológica Endovenosa, Intramuscular ou Subcutânea" (DUT nº 65) proporcionando uma estrutura normativa para o uso desses medicamentos. Foram incorporados benralizumabe, dupilumabe e mepolizumabe para asma eosinofílica grave88; dupilumabe e omalizumabe para asma alérgica grave89; dupilumabe para dermatite atópica90 e omalizumabe para urticária crônica espontânea91. As doenças, os imunobiológicos e suas respectivas DUTs são apresentados na Tabela 17.
A inclusão de imunobiológicos para tratamento de doenças alérgicas no SUS e na ANS é um marco para a saúde pública e suplementar no Brasil. Mesmo diante dos desafios financeiros e logísticos que envolvem essas incorporações, os avanços são promissores e têm o potencial de transformar o tratamento de doenças alérgicas graves até então não contempladas. Entretanto, o uso racional desses medicamentos de alto custo é uma estratégia essencial para manter a sustentabilidade dos sistemas de saúde, ao mesmo tempo em que proporciona melhoria significativa na qualidade da assistência médica aos pacientes, tanto no serviço público quanto no privado.
Considerações finais
Estamos completando duas décadas do licenciamento do primeiro imunobiológico para tratamento de doença alérgica: omalizumabe para asma grave. Ao longo desse período ocorreu uma grande expansão na terapia biológica de doenças alérgicas moderadas a graves. Em nosso país, nos últimos anos, o acesso à terapia biológica tornou-se uma realidade com a incorporação de vários imunobiológicos no SUS e na saúde suplementar.
Atualmente, a prescrição de imunobiológicos faz parte do arsenal terapêutico de todos os Alergistas e Imunologistas. Além dos conhecimentos teóricos e técnicos, a prescrição de imunobiológicos em doenças alérgicas deve envolver reflexão sobre aspectos da prática clínica, tais como monitoramento de resposta, eventos adversos, cuidados com a aplicação e acesso, bem como a relação custos versus benefícios.
Avanços estão continuamente ocorrendo, incluindo o desenvolvimento de novos biológicos, ampliação da faixa etária para uso e novas indicações para biológicos já licenciados. Além disso, alguns pacientes podem ter benefícios do uso combinado de dois biológicos para condições alérgicas concomitantes (ex.: dermatite atópica e urticária) ou para a potencialização de efeitos no tratamento de uma única condição alérgica (ex.: asma), envolvendo múltiplos mecanismos patogênicos92. Existem ainda casos de pacientes com doenças alérgicas e outras doenças também com indicação para terapia biológica (ex.: asma e doença de Crohn)93. Contudo, a experiência ainda é bastante limitada, e a associação de biológicos deve ser reservada a casos excepcionais, a partir de decisão compartilhada entre os médicos prescritores e o paciente.
Finalmente, é preciso ressaltar que os imunobiológicos são medicamentos novos, e, portanto, algumas recomendações contidas nesse guia ainda não possuem a robustez científica desejável. Sendo assim, devem ser interpretadas à luz das evidências atuais e experiências regionais, devendo ser atualizadas periodicamente.
Referências
1. Solé D, Sano F, Rosário NA, Antila MA, Aranda CS, Chong-Neto HJ, et al. Guia prático de atualização: medicamentos biológicos no tratamento da asma, doenças alérgicas e imunodeficiências. Arq Asma Alergia Imunol. 2019;3:207-58.
2. Morita H, Matsumoto K, Saito H. Biologics for allergic and immunologic diseases. J Allergy Clin Immunol. 2022;150:766-77.
3. Ministério da Saúde. Secretaria de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde- SCTIIE. Protocolo Clínico e Diretrizes Terapêuticas da Asma [Internet]. Brasília, 98 p, 2021. Disponível em: https://www.gov.br/conitec/pt-br/midias/consultas/relatorios/2021/20210526_pcdt_relatorio_asma_cp_39.pdf. Acessado em: 30/10/2023.
4. Agência Nacional de Saúde Suplementar (ANS). Rol de Procedimentos e Eventos em Saúde. Anexo II. Diretrizes de Utilização para a Cobertura de Procedimentos na Saúde Suplementar [Internet]. Rio de Janeiro, 191 p, 2022. Disponível em: https://www.gov.br/ans/pt-br/arquivos/assuntos/consumidor/o-que-seu-plano-deve_cobrir/Anexo_II_DUT_2021_RN_465.2021_tea.br_RN473_RN477_RN478_RN480_RN513_RN536_RN537
_RN538_RN539_RN540_RN541_RN542_RN544_546_550_553_571.pdf. Acessado em: 30/10/2023.
5. Agache I, Cojanu C, Laculiceanu A, Rogozea L. Critical Points on the Use of Biologicals in Allergic Diseases and Asthma. Allergy Asthma Immunol Res. 2020;12:24-41.
6. Sitek AN, Li JT, Pongdee T. Risks and safety of biologics: A practical guide for allergists. World Allergy Organ J. 2023;16:100737.
7. Guntern P, Eggel A. Past, present, and the future of anti-IgE biologics. Allergy. 2020;75:2491-502.
8. Bousquet J, Wahn U, Meltzer EO, Fox H, Hedgecock S, Thomas K, et al. Omalizumab: an anti-immunoglobulin E antibody for the treatment of allergic respiratory diseases. Eur Respir Rev. 2008;17:1-9.
9. Hanania NA, Wenzel S, Rose K, Hsieh HJ, Mosesova S, Choy DF, et al. Exploring the Effects of Omalizumab in Allergic Asthma: An Analysis of Biomarkers in the EXTRA Study. Am J Respir Crit Care Med. 2013;187:804-11.
10. Gill MA, Liu AH, Calatroni A, Krouse RZ, Shao B, Schiltz A, et al. Enhanced plasmacytoid dendritic cell antiviral responses after omalizumab. J Allergy Clin Immunol. 2018;141:1735-43.
11. Bousquet J, Humbert M, Gibson PG, Kostikas K, Jaumont X, Pfister P, et al. Real-world effectiveness of omalizumab in severe allergic asthma: a meta-analysis of observational studies. J Allergy Clin Immunol Pract. 2021;9:2702-14.
12. Gevaert P, Omachi TA, Corren J, Mullol J, Han J, Lee SE, et al. Efficacy and safety of omalizumab in nasal polyposis: 2 randomized phase 3 trials. J Allergy Clin Immunol. 2020;146:595-605.
13. Bauer A, Dickel H, Jakob T, Kleinheinz A, Lippert U, Metz M, et al. Expert consensus on practical aspects in the treatment of chronic urticaria. Allergo J Int. 2021;24:1-12.
14. Xolair®- bula profissional [Internet]. Disponível em https://portal.novartis.com.br/medicamentos/wp-content/uploads/
2021/10/Bula-XOLAIR-solucao-injetavel-Medico.pdf. Acessado em: 30/10/2023.
15. Zuberbier T, Latiff AHA, Abuzakouk M, Aquilina S, Asero R, Baker D, et al. The international EAACI/GA2LEN/EuroGuiDerm/APAAACI guideline for the definition, classification, diagnosis, and management of urticaria. Allergy. 2022;77:734-66.
16. Barakat L, Torres MJ, Phillips EJ, Caminati M, Chang YS, Caimmi D, et al. Biological treatments in allergy: prescribing patterns and management of hypersensitivity reactions. J Allergy Clin Immunol Pract. 2021;9:1396-9.
17. Baker DL, Nakamura GR, Lowman HB, Fischer SK. Evaluation of IgE Antibodies to Omalizumab (Xolair®) and Their Potential Correlation to Anaphylaxis. AAPS J. 2016 Jan;18:115-23.
18. Urgert MC, Van den Elzen MT, Knulst AC, Fedorowicz Z, Van Zuuren EJ. Omalizumab in patients with chronic spontaneous urticaria: a systematic review and GRADE assessment. Br J Dermatol. 2015;173:404-15.
19. Tharp MD, Bernstein JA, Kavati A, Ortiz B, MacDonald K, Denhaerynck K, et al. Benefits and Harms of Omalizumab Treatment in Adolescent and Adult Patients With Chronic Idiopathic (Spontaneous) Urticaria: A Meta-analysis of "Real-world" Evidence. JAMA Dermatol. 2019 Jan 1;155(1):29-38.
20. Varrichi G, Bagnasco D, Borriello F, Heffler E, Canonica GW. Interleukin-5 pathway inhibition in the treatment of eosinophilic respiratory disorders: evidence and unmet needs. Curr Op Allergy Clin Immunol. 2016;16:186-200.
21. Agache I, Beltran J, Akdis C, Akdis M, Canelo-Aybar C, Canonica GW, et al. Efficacy and safety of treatment with biologicals (benralizumab, dupilumab, mepolizumab, omalizumab and reslizumab) for severe eosinophilic asthma. A systematic review for the EAACI recomendations on the use of biologicals in severe asthma. Allergy. 2020;75:1023-42.
22. Nucala® - Bula profissional [Internet]. Disponível em https://br.gsk.com/media/6289/nucala-solução-injetável.pdf. Acessado em: 30/10/2023.
23. Jappe U, Beckert H, Bergmann KC, Gülsen A, Klimek L, Phillip S, et al. Biologics for atopic diseases: Indications, side effect management, and new development. Allergologie Select, 2021;5:1-25.
24. Saco TV, Pepper AN, Lockey RF. Benralizumab for the treatment of asthma. Expert Rev Clin Immunol. 2017;13:405-13.
25. Fasenra® - Bula profissional [Internet]. Disponível em: https://www.azmed.com.br/content/dam/multibrand/
br/pt/azmed-2022/home/bulas-profissionais/bulas/Fasenra_Bula_Profissional.pdf. Acessado em: 30/10/2023.
26. Dortas-Junior SD, Costa AJF, Guidacci MFRC, Sarinho FW, Serpa FS, Silva EC, et al. Reações adversas aos anticorpos monoclonais para doenças alérgicas. Arq Asma Alerg Imunol. 2022;6:318-24.
27. Harb H, Chatila TA. Mechanisms of Dupilumab. Clin Exp Allergy. 2020;50:5-14.
28. Fania L, Moretta G, Antonelli F, Scala E, Abeni D, Albanesi C, et al. Multiples roles for cytokines in atopic dermatites: from pathogenic mediators to endotype specific biomarkers to therapeutic targets. Int J Mol Sci. 2022;23:2684.
29. Dupixent®- Bula profissional [Internet]. Disponível em: https://www.4bio.com.br/wp-content/uploads/2019/06/Dupixent.pdf. Acessado em: 30/10/2023.
30. Beck LA, Thaçi D, Deleuran M, Blauvelt A, Bissonnette R, de Bruin-Weller M, et al. Dupilumab Provides Favorable Safety and Sustained Efficacy for up to 3 Years in an Open-Label Study of Adults with Moderate-to-Severe Atopic Dermatitis. Am J Clin Dermatol. 2020;21:567-77.
31. Weshley ME, Ford LB, Maspero JF, Pavord ID, Papi A, Bourdin A, et al. Long-term safety and efficacy of dupilumab in patients with moderate-to-severe asthma (TRAVERSE): an open-label extension study. Lancet Respir Med. 2022 Jan;10:11-25.
32. Agache I, Akdis CA, Akdis M, Brockow K, Chivato T, Del Giacco S, et al. EAACI Biologicals guidelines-dupilumab for children and adults with moderate-to-severe atopic dermatitis. Allergy. 2021;76:988-1009.
33. Jo CE, Finstad A, Georgakopoulos JR, Piguet V, Yeung J, Drucker AM. Facial and neck erythema associated with dupilumab treatment: A systematic review. J Am Acad Dermatol. 2021;84:1339-47.
34. Gauvreau GM, Sehmi R, Ambrose CS, Griffiths JM. Thymic stromal lymphopoietin: Its role and potential as a therapeutic target in asthma. Expert Opin Ther Targets. 2020;24:777-92.
35. Pelaia C, Pelaia G, Crimi C, Maglio A, Gallelli L, Terracciano R, et al. Tezepelumab: A Potential New Biological Therapy for Severe Refractory Asthma. Int J Mol Sci. 2021 Apr 22;22(9):4369.
36. Kurihara M, Kabata H, Irie M, Fukunaga K. Current summary of clinical studies on anti-TSLP antibody, Tezepelumab in asthma. Allergology International. 2023;72:24-30.
37. Corren J, Menzies-Gow A, Chupp G, Israel E, Korn S, Cook B, et al. Efficacy of Tezepelumab in Severe, Uncontrolled Asthma: Pooled Analysis of the PATHWAY and NAVIGATOR Clinical Trials. Am J Respir Crit Care Med. 2023 Jul 1;208(1):13-24.
38. Global Initiative of Asthma- GINA Report 2023 [Internet]. Disponível em: https://ginasthma.org/wp-content/uploads/
2023/07/GINA-2023-Full-report-23_07_06-WMS.pdf. Acessado em: 30/10/2023.
39. Tezspire®- Bula profissional [Internet]. Disponível em: https://www.azmed.com.br/content/dam/multibrand/br/pt/azmed-2022/home/bulas-profissionais/bulas/Tezspire_Bula_Profissional.pdf. Acessado em: 30/10/2023.
40. Menzies-Gow A, Wechsler ME, Brightling CE, Korn S, Corren J, Israel E, et al. Long-term safety and efficacy of tezepelumab in people with severe, uncontrolled asthma (DESTINATION): a randomised, placebo-controlled extension study. Lancet Respir Med. 2023;11:425-38.
41. Pepper AN, Hanania NA, Humbert M, Casale TB. How to Assess Effectiveness of Biologics for Asthma and What Steps to Take When There Is Not Benefit. J Allergy Clin Immunol Pract. 2021 Mar;9(3):1081-8.
42. Papaioannou AI, Fouka E, Bartziokas K, Kallieri M, Vontetsianos A, Porpodis K, et al. Defining response to therapy with biologics in severe asthma: from global evaluation to super response and remission. Expert Rev Respir Med. 2023;17:481-93.
43. Brasil. Ministério da Saúde. Secretaria de Atenção Especializada à Saúde. Secretaria de Ciência, Tecnologia e Insumos Estratégicos em Saúde. Protocolo Clínico e Diretrizes Terapêuticas da Asma 2021 [Internet]. Disponível em: https://www.gov.br/conitec/pt-br/midias/protocolos/20210830_pcdt_asma_pt14.pdf/view. Acessado em: 30/10/2023.
44. Giménez Arnau AM, Valero Santiago A, Bartra Tomás J, Jáuregui Presa I, Labrador Horrillo M, Miquel Miquel FJ, et al. Therapeutic strategy according to differences in response to Omalizumab in patients with chronic spontaneous urticaria. J Investig Allergol Clin Immunol. 2019;29:338-48.
45. Agache I, Akdis CA, Akdis M, Brockow K, Chivato T, Del Giacco S, et al. EAACI Biologicals Guidelines-Omalizumab for the treatment of chronic spontaneous urticaria in adults and in the paediatric population 12-17 years old. Allergy. 2022;77:17-38.
46. Simpson EL, Bieber T, Guttman-Yassky E, Beck L, Blauvelt A, Cork MJ, et al. SOLO 1 and SOLO 2 Investigators. Two phase 3 trials of dupilumab vs. placebo in atopic dermatitis. N Engl J Med. 2016;375:2335-48.
47. Blauvelt A, de Bruin-Weller M, Gooderham M, Cather JC, Weisman J, Pariser D, et al. Long term management of moderate-to-severe atopic dermatitis with dupilumab and concomitant topical corticosteroids (LIBERTY AD CHRONOS): a 1-year, randomised, double-blinded, placebocontrolled, phase 3 trial. Lancet. 2017;389:2287-303.
48. Bruin-Weller M, Thaçi D, Smith CH, Reich K, Cork MJ, Radin A, et al. Dupilumab with concomitant topical corticosteroid treatment in adults with atopic dermatitis with an inadequate response or intolerance to ciclosporin A or when this treatment is medically inadvisable: a placebo-controlled, randomized phase III clinical trial (LIBERTY AD CAFÉ). Br J Dermatol. 2018;178:1083-101.
49. Simpson EL, Paller AS, Siegfried EC, Boguniewicz M, Sher L, Gooderham MJ, et al. Efficacy and safety of dupilumab in adolescents with uncontrolled moderate to severe atopic dermatitis: a phase 3 randomized clinical trial. JAMA Dermatol. 2020;156:44-56.
50. Paller AS, Siegfried EC, Thaçi D, Wollenberg A, Cork MJ, Arkwright PD, et al. Efficacy and safety of dupilumab with concomitant topical corticosteroids in children 6 to 11 years old with severe atopic dermatitis: A randomized, double-blinded, placebo-controlled phase 3 trial. J Am Acad Dermatol. 2020 Nov;83(5):1282-93.
51. Paller AS, Simpson EL, Siegfried EC, Cork MJ, Wollenberg A, Arkwright PD, et al. Dupilumab in children aged 6 months to younger than 6 years with uncontrolled atopic dermatitis: a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2022;400:908-19.
52. Torres T, Gonçalo M, Lopes MJP, Claro C, Ramos L, Selores M, et al. Portuguese recommendations for the treatment of atopic dermatitis with biologic therapy and JAK inhibitors in adult patients. Drugs Context. 2021;10:2021-9-5.
53. Bachert M, Han JK, Wagenmann M, Hosemann W, Lee SE, Backer V, et al. EUFOREA expert board meeting on uncontrolled severe chronic rhinosinusitis with nasal polyps (CRSwNP) and biologics: Definitions and management. J Allergy Clin Immunol. 2021;147:29-36.
54. Dhar A, Haboubi HN, Attwood SE, Auth MKU, Dunn JM, Sweis R, et al. British Society of Gastroenterology (BSG) and British Society of Paediatric Gastroenterology, Hepatology and Nutrition (BSPGHAN) joint consensus guidelines on the diagnosis and management of eosinophilic esophagitis in children and adults. Gut. 2022;71:1459-87.
55. Dellon ES, Rothemberg ME, Collins MH, Hirano I, Chehade M, Bredenoord AJ, et al. Dupilumab in adults and adolescents wuth eosinophilic esophagitis. N Engl J Med. 2022;387:2317-30.
56. Hirano I, Furuta GT. Approaches and Challenges to management of pediatric and adult patients with eosinophilic esophagitis. Gastroenteroloy. 2020;158:840-51.
57. Dellon ES, Irani AM, Hill MR, Hirano I. Development and field testing of a novel patient-reported outcome measure of dysphagia in patients with eosinophilic esophagitis. Aliment Pharmacol Ther. 2013 Sep;38(6):634-4.
58. Hirano I, Collins MH, Katza DA, Mukkada VA, Falk GW, Morey R, et al. Clin Gastroenterol Hepatol. 2022;20:525-34.
59. Requena G, Van den Bosch J, Akuthota P, Kovalszki A, Steinfeld J, Kwon N. Clinical Profile and Treatment in Hypereosinophilic Syndrome Variants: A Pragmatic Review. J Allergy Clin Immunol Pract. 2022;10:2125-34.
60. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária-ANVISA. Nucala (mepolizumabe): nova indicação [Internet]. Disponível em: https://www.gov.br/anvisa/pt-br/assuntos/medicamentos/novos-medicamentos-e-indicacoes/
nucala-mepolizumabe-nova-indicacao. Acessado em: 30/10/2023.
61. Roufosse F, Hahn JE, Rothember ME, Wardlaw AJ, Kilon AD, Kirby SY, et al. J Allergy Clin Immunol. 2020;146:1397-405.
62. Gleich GJ, Roufosse F, Chupp G, Faguer S, Walz B, Reiter A. Safety and Efficacy of Mepolizumab in Hypereosinophilic Syndrome: An Open-Label Extension Study. J Allergy Clin Immunol Pract. 2021;9:4431-40.
63. Carbonnel F, Wending D. The complexity of adverse side effects to biological agents. J Crohns Colitis. 2013;7:257-62.
64. Pichler WJ. Adverse side-effects to biological agents. Allergy. 2006 Aug;61:912-20.
65. Guex-Crosier Y, Di-Lucca J, Hausermann P, Laffitte E, Saulite I, Smitd-Grendelmeier et al. Management of dupilumab-associated ocular surface diseases in atopic dermatitis patients. Swiss Med Weekly. 2021;151:w30020.
66. Baddini-Martinez J, Filho FSL, Caetano LSB. Riscos anafiláticos associados a agentes imunobiológicos na terapia da asma Rev Assoc Med Bras. 2023;69:367-9.
67. Bavbek S, Pagani M, Alvarez-Cuesta E, Castells M, Dursun AB, Hamadi S, et al. Hypersensitivity reactions to biologicals: An EAACI position paper. Allergy. 2022;77:39-54.
68. Associação Brasileira de Alergia e Imunologia- ASBAI. Departamento Científico de Imunobiológicos 2023-2024. Esclarecendo ASBAI nº 3, junho 2023 [Internet]. Disponível em: https://asbai.org.br/esclarecendo-no-3/. Acessado em: 30/10/2023.
69. Chow TG, Oppenheimer J, Joshi SR. A Review of Adverse Reactions to Biologics Used in Allergy-Immunology Practice. J Allergy Clin Immunol Pract. 2022;10:3075-86.
70. Associação Brasileira de Alergia e Imunologia- ASBAI. Departamento Científico de Imunobiológicos 2021-2022. Recomendações de vacinação para COVID-19 em pacientes em uso de medicamentos imunobiológicos [Internet]. Disponível em: https://asbai.org.br/wp-content/uploads/2021/03/2021-03-22-Imunobiolo%CC%81gicos_COVID-19_PAPEL-CARTA.pdf. Acessado em: 30/10/2023.
71. Martinez-Cabriales SA, Kirchhof MG, Constantinescu CM, Murguia-Favela L, Ramien ML. Recommendations for Vaccination in Children with Atopic Dermatitis Treated with Dupilumab: A Consensus Meeting, 2020. Am J Clin Dermatol. 2021;22,443-55.
72. Simonetti O, Rizzetto G, Molinelli E, Diotallevi F, Radi G, Cirioni O, et al. Safety and Efficacy of Vaccines during COVID-19 Pandemic in Patients Treated with Biological Drugs in a Dermatological Setting. Healthcare. 2021;9:401.
73. Fan R, Cohen JM. Vaccination Recommendations for Psoriasis and Atopic Dermatitis Patients on Biological Therapy: A Practical Guide. Yale J Biol Med. 2022;95:249-55.
74. Sociedade Brasileira de Imunizações. Guia de Vacinação da Sociedade Brasileira de Imunizações (SBIm) 2023-2024 [Internet]. Disponível em: https://sbim.org.br/images/calendarios/calend-sbim-pacientes-especiais.pdf. Acessado em: 30/10/2023.
75. Mishra AK, Sahu KK, James A. Disseminated herpes zoster following treatment with benralizumab. Clin Respir J. 2019 Mar;13(3):189-91.
76. Cruz AA, Lima F, Sarinho E, Aire G, Martin C, Fox H, et al. Safety of antiimmunoglobulin E therapy with omalizumab in allergic patients at risk of geohelminth infection. Clin Exp Allergy. 2007;37:197-207.
77. Namazy J, Cabana MD, Scheuerle AE, Thorp JM Jr, Chen H, Carrigan G, et al. The Xolair Pregnancy Registry (EXPECT): the safety of omalizumab use during pregnancy. J Allergy Clin Immunol. 2015 Feb;135(2):407-12.
78. Kulthanan K, Rujitharanawong C, Munprom K, Trakanwittayarak S, Phumariyapong P, Prasertsook S, et al. Prevalence, clinical manifestations, treatment, and clinical course of chronic urticaria in elderly: A systematic review. Journal of Asthma and Allergy, 2015;15:1455-90.
79. Jacoby TV, Shah N, Asdourian MS, Thompson LL, Otto TS, LeBoeuf NR, et al. Dermatology evaluation for cutaneous immune-related adverse events is associated with improved survival in cancer patients treated with checkpoint inhibition. J Am Acad Dermatol. 2023 Mar;88(3):711-4.
80. Narváez-Fernández EJ, Entrala A, Nin-Valencia A, Mir-Ihara P, Losantos-García I, Domínguez-Ortega J, et al. Long-Term Omalizumab in Elderly Patients with Chronic Urticaria: Is It a Safe Therapy? Int Arch Allergy Immunol. 2023;184(10):1003-9.
81. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde e Ambiente. Departamento de Imunizações e Doenças Imunopreveníveis. Manual dos Centros de Referência para Imunobiológicos Especiais. 6a ed. Brasília: Ministério da Saúde; 2023. 176p [Internet]. Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/manual_centros_referencia_imunobiologicos_6ed.pdf. Acessado em: 30/10/2023.
82. King C, Cox F, Sloan A, McCrea P, Edgar JD, Conlon N. Rapid transition to home omalizumab treatment for chronic spontaneous urticaria during the COVID-19 pandemic: A patient perspective. World Allergy Organ J. 2021 Oct;14:100587.
83. Novartis United States of America. Novartis receives FDA approval of Xolair® (omalizumab) self-injection with prefilled syringe across all indications for appropriate patients [site na Internet]. Disponível em: https://www.novartis.com/us-en/news/media
-releases/novartis-receives-fda-approval-xolair-omalizumab-self-injection-prefilled-syringe-across-all-indications-appropriate-patients. Acessado em: 30/10/2023.
84. Flokstra-de Blok B, Kocks J, Wouters H, Arling C, Chatelier J, Douglass J, et al. Perceptions on Home-Administration of Biologics in the Context of Severe Asthma: An International Qualitative Study. J Allergy Clin Immunol Pract. 2022 Sep;10(9):2312-2323.e2.
85. Lombardi C, Bagnasco D, Passalacqua G. Biological agents for severe asthma: the evolution of the at-home self-injection approach. Curr Opin Allergy Clin Immunol. 2020 Aug;20(4):421-7.
86. Li L, Wang Z, Cui L, Xu Y, Guan K, Zhao B. Anaphylactic risk related to omalizumab, benralizumab, reslizumab, mepolizumab, and dupilumab. Clin Transl Allergy. 2021;11(4):e12038.
87. Brasil. Ministério da Saúde. Protocolo Clínico e Diretrizes Terapêuticas da Asma. Portaria Conjunta Nº 14, de 24 de agosto de 2021 [Internet]. Disponível em: https://www.gov.br/saude/pt-br/assuntos/protocolos-clinicos-e-diretrizes-terapeuticas
-pcdt/arquivos/2021/portal-portaria-conjunta-no-14_pcdt_asma_.pdf. Acessado em: 30/10/2023.
88. Brasil. Ministério da Saúde. Agência Nacional de Saúde Suplementar. Resolução Normativa Nº 513, de 31 de março de 2022 [Internet]. Disponível em https://bvsms.saude.gov.br/bvs/saudelegis/ans/2022/res0513_01_04_2022.html. Acessado em: 30/10/2023.
89. Brasil. Ministério da Saúde. Agência Nacional de Saúde Suplementar. Resolução Normativa Nº 550, de 4 de novembro de 2022 [Internet]. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/ans/2022/res0550_09_11_2022.html. Acessado em: 30/10/2023.
90. Brasil. Ministério da Saúde. Agência Nacional de Saúde Suplementar. Resolução Normativa Nº 571, de 8 de fevereiro de 2023 [Internet]. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/ans/2023/res0571_10_02_2023.html. Acessado em: 30/10/2023.
91. Brasil. Ministério da Saúde. Agência Nacional de Saúde Suplementar. Resolução Normativa Nº 465, de 24 de fevereiro de 2021 [Internet]. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/ans/2021/res0465_02_03_2021.html. Acessado em: 30/10/2023.
92. Pitlick MM, Pongdee T. Combining biologics targeting eosinophils (IL-4/IL-5R), IgE and IL-4/IL-13 in allergic and inflammatory diseases. W Allergy Org. 2022;15:100707.
93. Gisondi P, Maurelli M, Costanzo A, Esposito M. The combination of dupilumab with other monoclonal antibodies. Dermatol Ther. 2023;13:7-12.